«Алюминий» или «аллюминий», как правильно?
Слово «алюминий» пишется с одной буквой «л» в корне.
Часто возникает вопрос, как правильно пишется слово «алюминий» или «аллюминий»? Чтобы выбрать правильный вариант написания этого существительного с одной буквой или с двойными согласными в корне обратимся к его происхождению.
Правописание слова «алюминий»
Интересующее нас слово является заимствованным в русском языке. Оно начинается с гласной «а». Что интересно, почти все лексемы с начальной гласной «а» являются заимствованными в русском языке. Следы рассматриваемого слова приведут нас в латинский язык, где исходное aluminis значит «квасцы». Как видим, в языке-источнике в слове пишется одна буква «л». В таком виде данное существительное пришло в русский язык и сохраняет это написание.
Слово «алюминий» пишется с одной буквой «л» в корне.
Алюминий всем знаком!
Нам исправно служит он.
Втрое он полегче стали.
Прочен в сплавах и притом
Смело входит в каждый дом.
Провода висят у вас? Это раз!
Если есть сковорода — это два!
Самолет и теплоход,
Трактор или вездеход —
Для любых таких конструкций
Алюминий подойдёт!

Такое же написание прослеживается в однокоренном прилагательном «алюминиевый», существительном «алюмель» (сплав никеля с алюминием), «алюминаты» и в сложных словах-терминах «алюминотермия», «алюмосиликаты».
Буквой «л» передается на письме звонкий сонорный звук [л’], который произносится с известной долей голоса по сравнению с другими согласными, которые произносятся довольно коротко, с шумом и имеют пары по признаку звонкости/глухости :
б-п, в-ф, г-к, д-т, ж-ш, з-с.
Видимо, поэтому при произношении слова
Укажем ряд заимствованных слов, в корне которых, несмотря на произношение, пишется также одна буква «л» :
- алогизм, балюстрада, галерея, галантерея, галета, кавалерия;
- калория, калорийный, калорийность, количество, колорит.
Написание перечисленных слов запомним или в случае затруднения справимся о них в орфографическом словаре.
russkiiyazyk.ru
Алюминий или алюминий как правильно, как пишется алюминиевая?
В данном слове ударение ставят на слог с первой буквой И — алюм
От этих цифр может и спать расхотеться… Понятно, почему на Ангаре с ее дешевой электроэнергией сосредоточены самые дорогие энергоемкие производства: бездоменное получение железа и стали на электроплавке, производство искусственного каучука, производство искусственного шелка из еловой древесины, производство алюми́ния из алунита — все такие производства, которые на дорогом топливе невыгодны.
Как правильно пишется слово «алюминиевый»?
— Григорий Адамов, Изгнание владыки. Роман. Рассказы
Но если его сплавить с ничтожными количествами меди, марганца и магния, то полученный сплав (дюралюминий) приобретает твердость стали, сохраняя при этом легкость
Сущность этой реакции заключалась в том, что если смешать окись железа (окалина, порошок ржавчины и т. п.) с порошком алюми́ния и смесь эту поджечь, то алюминий в процессе горения отнимет у окиси железа кислород, восстанавливая тем самым чистое железо, а сам окислится; образующаяся при этом избыточная тепловая энергия расплавит железо, а полученная окись алюми́ния всплывет на поверхность в виде шлака. — Григорий Адамов, Тайна двух океанов
Вот эта смесь окиси железа с порошком алюми́ния и носит название термита, и, с тех пор как «реакция Гольдшмид-та» стала известной, она долго применялась лишь для получения некоторых простейших ферросплавов и особенно для сварки рельсов. — Григорий Адамов, Тайна двух океанов
На ней да и на соседях ее – Луне, Марсе, Венере – много алюми́ния, вообще редкого во Вселенной. — Иван Ефремов, Туманность Андромеды
На данной странице указано на какой слог правильно ставить ударение в слове алюминия. В слове «алюминия» ударение должно быть поставлено на слог с первой буквой И — алюми́ния. Надеемся, что теперь у вас не возникнет вопросов, как пишется слово алюминия, куда ставить ударение, какое ударение, или где должно стоять ударение в слове алюминия, чтобы грамотно его произносить.
В данном слове ударение должно быть поставлено на слог с первой буквой И — алюм
Лёгкая алюми́ниевая лестница зацепилась за борт, и главарь первым полез наверх. — М. Г. Серегин, Короткий путь на дно, 2010
Это были мука, цинковая пыль, алюми́ниевая пудра, халькопирит и др. — Евгений Чухманов, История одного открытия. История одного убийства. Остросюжетная криминальная повесть
В углу клетки стояла алюми́ниевая миска с едой, но лисёнок ни разу даже не взглянул на неё. — Мария Инари-Колесникова, Лаки, девочка-кошка, 2015
Лучший вариант — добротный стеклопластиковый корпус, алюми́ниевая мачта, такелаж из нержавеющей стали и дизельный двигатель. — Кеннет Ньюмейер, Ковчег для Робинзона. Все о жизни морского кочевника
Это была чёрная обгорелая алюми́ниевая проволока. — Анатолий Фатеев, Кладовая ужасов. Новая ступень в жанре Российских ужасов
Лёгкая алюми́ниевая лестница зацепилась за борт, и главарь первым полез наверх. — М.
Как правильно аллюминий или алюминий?
Г. Серегин, Короткий путь на дно, 2010
Это были мука, цинковая пыль, алюми́ниевая пудра, халькопирит и др. — Евгений Чухманов, История одного открытия. История одного убийства. Остросюжетная криминальная повесть
Лучший вариант — добротный стеклопластиковый корпус, алюми́ниевая мачта, такелаж из нержавеющей стали и дизельный двигатель. — Кеннет Ньюмейер, Ковчег для Робинзона. Все о жизни морского кочевника
В углу клетки стояла алюми́ниевая миска с едой, но лисёнок ни разу даже не взглянул на неё. — Мария Инари-Колесникова, Лаки, девочка-кошка, 2015
Это была чёрная обгорелая алюми́ниевая проволока. — Анатолий Фатеев, Кладовая ужасов. Новая ступень в жанре Российских ужасов
На текущей странице указано на какой слог правильно ставить ударение в слове алюминиевая. В слове «алюминиевая» ударение должно быть поставлено на слог с первой буквой И — алюми́ниевая. Надеемся, что теперь у вас не возникнет вопросов, как пишется слово алюминиевая, куда ставить ударение, какое ударение, или где должно стоять ударение в слове алюминиевая, чтобы грамотно его произносить.
Обозначение алюминия на чертежах
Алюминий – это металл, имеющий высокую степень пластичности, серебристо-белый цвет и относительно небольшую удельную массу.
Как пишется слово алюминий или аллюминий?
Одной из его характерных особенностей является способность при контакте с воздушной средой очень быстро покрываться прочной оксидной пленкой, отлично защищающей его от коррозионного разрушения.
Алюминий обладает высокой устойчивостью к воздействию многих кислот (как органических, так и неорганических, к примеру, азотной), однако быстро подвергается разрушению при контакте с серной и соляной кислотами, а также со щелочами. Его практическое применение во многом определяется тем, что он при достаточно высокой прочности обладает небольшой плотностью.
Что касается степени подверженности механической обработке, то алюминий отлично поддается ковке, штамповании и прокатыванию. Его удельный вес в три раза ниже, чем у стали и чугуна.
Алюминиевые сплавы
Сам по себе алюминий, то есть в чистом виде, не отличается высокой прочностью, и поэтому для изготовления различных элементов конструкций используются сплавы на его основе.
Эти материалы специалистами подразделяются на две основные категории: деформированные и литейные (другие их названия – дюралюминий и силумин).
Дюралюминий представляет собой сплав алюминия с такими металлами, как медь, марганец и магний. Для улучшения технологических свойств, его подвергают некоторым укрепляющим процедурам, а именно: упрочняющему старению и закалке, происходящей в воде после нагрева до температуры 500 °С.
После такой обработки механические свойства дюралюминия приближаются к тем, которыми обладают среднеуглеродистые стали. Это материал чаще всего используется в качестве проката (трубы, уголок, лист и т.п.) для производства деталей авиационного и наземного транспорта.
Силумин мягкий материал, обладающий великолепными литейными свойствами, применяется в основном для того, чтобы изготавливать различные детали неподверженные высоким нагрузкам, представляет собой сплав алюминия с кремнием.
Применение алюминия и его сплавов
Алюминий и самые разнообразные сплавы на его основе в технике сейчас применяются чрезвычайно широко. Наиболее часто детали из этих универсальных материалов можно встретить в продукции отраслей автомобильного и авиационного машиностроения, водного и железнодорожного транспорта, приборостроения, электротехники. Алюминиевые сплавы широко применяются в химической промышленности, а также в гражданском строительстве.
Алюминий и его сплавы являются одними из главных технических материалов при изготовлении головок цилиндров двигателей, корпусов коробок переключения передач, насосов. Из деталей, изготовленных из них, собираются фюзеляжи воздушных и корпуса водных судов, а элементы, произведенные из них, используются для отделки железнодорожных вагонов. Очень широко алюминий и его сплавы применяются в электротехнике и электронике.
Примеры условного обозначения
Пруток Д16.Т КР45 × 3000 ГОСТ 21488–97
Д16 – марка сплава;
Т – закалённое и естественно состаренное состояние материала;
КР – круглый;
– диаметр прутка;
– длинна.
Пруток Д16.Т КВ55 × 2000 ГОСТ 21488–97
Д16 – марка сплава;
Т – закалённое и естественно состаренное;
КВ – квадратный;
– размер сечения прутка;
– длинна.
Пруток Д16.Т ШГ22 × 2000 ГОСТ 21488–97
Д16 – марка сплава;
Т – закалённое и естественно состаренное;
ШГ – шестигранник;
– размер шестигранника;
– длинна.
Лист АМг2.М 1,5 × 1200 × 2000 ГОСТ 21631–76
АМг2 – марка сплава;
М – отожжённое состояние;
– толщина;
– ширина;
– длинна.
Лист Д16 2 × 1200 × 2000 ГОСТ 21631–76
АМг2 – марка сплава;
М – отожжённое состояние;
– толщина;
– ширина;
– длинна.
Добрый день, в существительном мужского рода алюминий необходимо писать одну согласную букву л, проверить количество букв правилами русского языка нельзя, так как слово является словарным, следует запомнить правильность его написания.
По правилам русского языка название лгкого серебристого металла quot;алюминийquot; пишется с одной буквой Л. Никаких проверочных слов в данном случае не существует, слово словарное и его просто нужно запомнить. Хотя так и тянет две Л написать, по себе знаю 🙂
Слово АЛЮМИНИЙ словарное, его написание следует запомнить. Оно произошло от латинского alumen, в родительном падеже aluminis-квасцы. Поэтому исходя из первоисточника согласная не удваивается. Производное от этого слова также пишется с одной Л: алюминиевый.
Слово алюминий так и хочется написать с двумя -лл-, может от слова металл, может еще на каком-то подсознательном уровне при произношении, но писать следует с одним -л-.
Правильно будет так — алюминий.
Слово алюминий проверить нельзя, так что придется просто запомнить его.
В русском языке встречается довольно много слов без двойной согласной, однако на практике многие пишут с ошибкой, ставя одну согласную, где требуется две и наооборот. К таким словам можно отнести слово алюминий. Это слово, обозначающее металл, принято писать в одной буквой Л. Написание данного слова нужно просто запомнить, чтобы в следующий раз не допускать подобную ошибку.
Слово алюминий заимствованное. Кстати, почти все слова, начинающиеся на гласный а, в русском языке являются пришельцами из других языков. Как тут не вспомнить родимую авоську и слово quot;авосьquot;!
Так что слово quot;алюминийquot; у всех на слуху.
Как видим, в языке-источнике исходное слово пишется с одной буквой л. Но при его написании в русском языке многим почему-то хочется удвоить букву quot;лquot;. Думаю, по той причине, что согласный quot;лquot; является непарным звонким, который произносится с большой долей голоса. Это сонорный звук, который занимает промежуточное положение между звонкими согласными и гласными. Несмотря на произношение, все же слово quot;алюминийquot; и производное прилагательное quot;алюминиевыйquot; пишется с одной буквой л, как и в языке, откуда идут корни этого существительного.
Это словарное слово.
Есть такая немного детская шутка, нужно спросить взрослого и грамотного человека: quot;Сколько букв Л в слове ал-л-л-люминий?quot; Некоторые попадаются и говорят, что две, хотя на самом деле одна. Просто произносишь так, как будто их две.) Скорее всего это словарное слово, проверить количество букв Л в корне слова никак нельзя.
Слово quot;алюминийquot; пишется с одно буквой quot;лquot;, без удвоения. Для проверки правописания надо смотреть в словарь, других способов проверить правильность нет. Еще известен вариант произношения quot;люминийquot;, он еще более неправильный, встречается в основном в армейских анекдотах.
С двумя буквами quot;лquot; пишутся слова quot;аллегроquot;, quot;аллюрquot;, quot;аллюзияquot;, quot;аллергияquot;, quot;аллигаторquot;, quot;аллитерацияquot;.
Алюминий — сложное словарное слово с сомнительными буквами. Пишется именно так: АЛЮМИНИЙ.
В ряде анекдотов упоминается легкий металл Люминий и тяжелый металл Чугуний. Я не призываю использовать эти исковерканные слова в своей речи, но воспользоваться ими для того, чтобы запомнить правильное написание слова Алюминий вполне возможно. Когда вы в очередной раз споткнетесь о существительное Алюминий и будете поспешно вспоминать сколько же согласных букв Л в этом слове, просто вспомните этот анекдот и слово Люминий, в котором уж точно эта согласная одна. По странному совпадению одна согласная Л и в правильном слове Алюминий.
Скажите, правильно пишется: «алюминиевый» профиль или «алюминевый», или может быть «аллюминиевый»?
А так это слово заимствованное и количество согласных в нем не проверяется, то оно конечно словарное.
Мне самой частенько хотелось написать это слова с удвоенной Л — аллюминий, вторая буковка так и просилась добавиться. Но все же правильно пишется это слово только с одной буквой Л — алюминий. Заглянем в словарь, там мы увидим, что слово к нам пришло из другого языка, в котором всего лишь одна буква L нем. Aluminium lt; лат. almen (alminis) квасцы
Насколько мне известно, в русском языке слово quot;Алюминийquot; пишется с одной буквой quot;Лquot;. Кроме того, от данного имени существительного может быть образовано и имя прилагательное, которое также пишется с одной буквой quot;Лquot;, а именно, quot;Алюминиевыйquot;.

Орфографический словарь русского языка советует писать алюминий с одной буквой quot;лquot;.
krasferret.ru
алюминий — это… Что такое алюминий?
АЛЮМИ́НИЙ -я; м. [от лат. alumen (aluminis) — квасцы]. Химический элемент (Al), серебристо-белый лёгкий ковкий металл с высокой электропроводностью (применяемый в авиации, электротехнике, строительстве, быту и т.п.). Сульфат алюминия. Сплавы алюминия.
АЛЮМИ́НИЙ (лат. Aluminium), Al (читается «алюминий»), химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3s2p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III).Радиус нейтрального атома алюминия 0,143 нм, радиус иона Al3+ 0,057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5,984, 18,828, 28,44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1,5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
История открытия
Латинское aluminium происходит от латинского же alumen, означающего квасцы (см. КВАСЦЫ) (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия (см. АЛЮМИНИЯ ОКСИД)) сделал еще в 1754 немецкий химик А. Маргграф (см. МАРГГРАФ Андреас Сигизмунд). Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед (см. ЭРСТЕД Ханс Кристиан). Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.
Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль (см. СЕНТ-КЛЕР ДЕВИЛЬ Анри Этьен) в 1854 предложил использовать для получения алюминия металлический натрий (см. НАТРИЙ), и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (см. ЭРУ Поль Луи Туссен) (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
Нахождение в природе
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов (см. АЛЮМОСИЛИКАТЫ), и горных пород. Соединения алюминия содержат граниты (см. ГРАНИТ), базальты (см. БАЗАЛЬТ), глины (см. ГЛИНА), полевые шпаты (см. ПОЛЕВЫЕ ШПАТЫ) и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов (см. БОКСИТЫ) — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты (см. АЛУНИТ) и нефелины (см. НЕФЕЛИН).
В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
Промышленное получение
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит (см. КРИОЛИТ) Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:
2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99,7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99,999% и более.
Физические и химические свойства
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1,663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3H2,
3Н2SO4 + 2Al = Al2(SO4)3 + 3H2.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты (см. АЛЮМИНАТЫ): Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число (см. КООРДИНАЦИОННОЕ ЧИСЛО) 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].
При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода (см. ИОД) начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:
2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений (см. АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ), можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.
В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Такой способ получения металлов называют алюминотермией (см. АЛЮМИНОТЕРМИЯ).
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yH2O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3Ї + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3NH3·H2O = Al(OH)3Ї + 3H2O + 3NH4Cl.
Применение
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65,5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (см. ДУРАЛЮМИН) (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумина (85—90% Al, 10—14% Si, 0,1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
Алюминий в организме
В организм человека алюминий ежедневно поступает с пищей (около 2—3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
dic.academic.ru
Как правильно пишется слово АЛЮМИНИЕВАЯ или АЛЮМИНЕВАЯ кастрюля?)
Олюминивая. Проверочное слово олюминивые агурцы.
АЛЮМИНИЕВАЯ от алюминий ванадий — ванадиевая, барий — бариевая, кадмий — кадмиевая, а от корица — коричневый, столица — столичный, черепица — черепичный
ЖЕЛЕЗНАЯ кастрюля!!!!=))
Уже все подсказали, но мне тоже хочется блеснуть знанием русского языка))) ) АЛЮМИНИЕВАЯ))
touch.otvet.mail.ru
Алюминий — свойства, харакретистики, обзорная статья
 Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде.
Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру. Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов. Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
Алюминий — это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель. В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит. С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл. Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов. Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур. При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов. Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения чистого глинозёма используют процесс Байера. В автоклаве руду нагревают с едким натром, охлаждают, отделяют от жидкости «красный шлам» (твёрдый осадок). После осаждают гидроокись алюминия из полученного раствора и прокаливают её для получения чистого глинозёма. Глинозём должен соответствовать высоким стандартам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия. Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С). Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля). Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ. Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия.
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
Алюминиевый лист
Алюминиевая плита
Алюминиевые чушки
Алюминиевые уголки
Алюминиевая проволока
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
cu-prum.ru
Алюминий. Описание, свойства, происхождение и применение металла

Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА
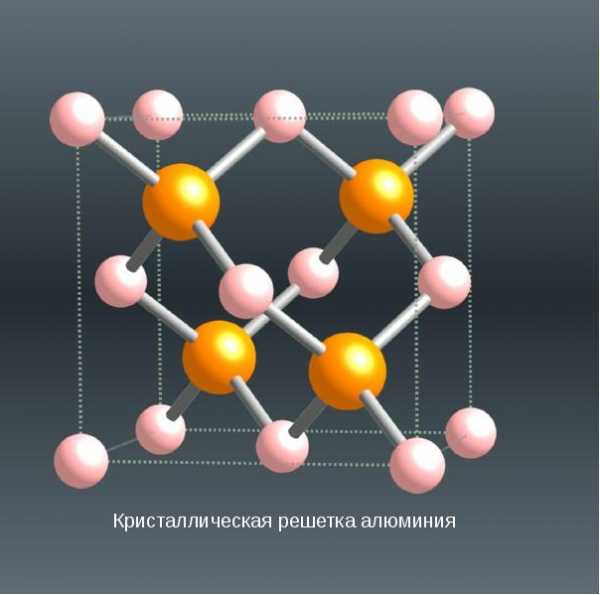
Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки. Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА
Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см3), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий (англ. Aluminium) — Al
| Молекулярный вес | 26.98 г/моль |
| Происхождение названия | от латинского alumen |
| IMA статус | утверждён в 1978 |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.21
| Strunz (8-ое издание) | 1/A.03-05 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.22.1 |
| Dana (8-ое издание) | 1.1.1.5 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | серовато-белый, белый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2-3 |
| Прочность | ковкий |
| Плотность (измеренная) | 2.7 г/см3 |
| Радиоактивность (GRapi) | 0 |
ОПТИЧЕСКИЕ СВОЙСТВА
Плеохроизмне плеохроирует
| Тип | изотропный |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
| Магнетизм | парамагнетик |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | (4/m 3 2/m) — изометричная гексаоктаэдральная |
| Пространственная группа | F m3m, P m3m |
| Сингония | кубическая |
| Параметры ячейки | a = 4.04Å |
Интересные статьи:
mineralpro.ru 26.07.2016mineralpro.ru
Алюминий — Мегаэнциклопедия Кирилла и Мефодия — статья
Радиус нейтрального атома алюминия 0, 143 нм, радиус иона Al3+ 0, 057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5, 984, 18, 828, 28, 44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1, 5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
Латинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 предложил использовать для получения алюминия металлический натрий, и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8, 8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины.В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99, 7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99, 999% и более.
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0, 40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2, 6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2, 5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1, 663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3H2,
3Н2SO4 + 2Al = Al2(SO4)3 + 3H2.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6H2O = 2Al(OH)3 + 3H2,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты: Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений, можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yH2O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3H2O + 3NH4Cl.
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65, 5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (94% Al, 4% Cu, по 0, 5% Mg, Mn, Fe и Si), силумина (85-90% Al, 10-14% Si, 0, 1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
В организм человека алюминий ежедневно поступает с пищей (около 2-3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
- Беляев А. И. История алюминия, в сб. Труды Института истории естествознания и техники, т. 20, М., 1959.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Промышленные алюминиевые сплавы. М., 1984.
megabook.ru
