Гидроксид натрия — химические или физические свойства, формула, применение в быту и медицине
С химическим соединением, называемым каустической содой, человек встречается ежедневно. Гидроксид натрия, химическая формула которого обозначается NaOH, относится к разряду едких и сильных щелочей, опасных для кожи и слизистых человека. Одновременно с этим она активно используется пищевой промышленностью, косметологией, фармацевтикой. Ни одно средство личной гигиены не обходится без добавления этого соединения. Химические свойства вещества сделали его самым популярным среди регуляторов кислотности и средств для поддержания консистенции.
Что такое гидроксид натрия
Это соединение – едкая щелочь, которая применяется не только пищевой, фармацевтической и косметической сферами, но и химической промышленностью. Гидроокись натрия, или каустическая сода, выпускается в виде немного скользких твердых гранул желтоватого или белого цвета.
Формула
Вещество имеет химическую формулу NaOH. Соединение взаимодействует с различными веществами любых агрегатных состояний, нейтрализуя их, с кислотами, образуя соль и воду. Реакция с атмосферными оксидами и гидроксидами позволяет получить тетрагидроксоцинкат или алкоголят. Едкий натр применяется для осаждения металлов. Например, при реакции с сульфатом алюминия образуется его гидроксид. Осадок не растворяется и не наблюдается избыточное получение щелочи. Это актуально при очистке воды от мелких взвесей.

Свойства
Соединение растворяется в воде. Технический Sodium Hydroxide представляет собой водный раствор гидроксида натрия в щелочеустойчивой герметичной таре. При взаимодействии с водой каустик выделяет большое количество тепла. Вещество имеет следующие свойства:
- при предварительном расплавлении разрушает стекло, фарфор;
- взаимодействие с аммиаком вызывает пожароопасную ситуацию;
- кипит при 1390°С, плавится, если температура достигает 318°С;
- не растворяется в эфирах, ацетоне;
- очень гигроскопичен (поглощает пары воды из воздуха), поэтому натриевая щелочь должна храниться в сухом месте и герметичной упаковке;
- растворяется в метаноле, глицерине, этаноле;
- бурно взаимодействует с металлами – оловом, гидроксидом алюминия, свинцом, цинком, образует водород – взрывоопасный горючий яд;
- поглощает углекислый газ из воздуха.
Получение
Каустическая сода встречается в составе минерала брусита. Второе по величине месторождение сконцентрировано на территории России. Гидроокись благодаря исследованиям Николы Леблана, проведенным в 1787 г., получают методом синтеза из хлористого натрия. Позже востребованным способом добычи стал электролиз. С 1882 г. ученые разработали ферритный метод получения в лаборатории гидроксида с помощью кальцинированной соды. Электрохимический способ сейчас самый популярный: ионы натрия образуют его раствор едкой ртути – амальгаму, которая растворяется водой.
Применение гидроксида натрия
Нет более распространенной щелочи, чем каустическая сода. Ежегодно потребляется порядка 57 млн т. Едкий натрий используется при получении лекарственных препаратов, фенола, органических красителей, глицерина. Еще одна сфера применения – дезинфекция помещения из-за способности химического соединения нейтрализовать вредные для человека вещества, находящиеся в воздухе. Еще гидроокиси широко используются для поддержания формы продуктов (пищевая промышленность).

В промышленности
Гидроокись натрия относится к сильной основе для химических реакций и активно применяется разными отраслями благодаря своим свойствам:
- Целлюлозной отраслью – для устранения сульфата в составе древесных волокон для размягчения (делигнификация). Это нужно при производстве картона, бумаги, искусственных волокон.
- Химической промышленностью – применяется для производства масел, нейтрализации веществ кислотной среды, при травлении алюминия, изготовлении чистых металлов.
- Гидроокись натрия используется для получения биодизельного топлива на основе растительных масел, в результате реакции образуется глицерин.
- Соединением омывают пресс-формы автомобильных покрышек.
- В гражданской обороне он распространен при нейтрализации опасных для здоровья веществ в воздухе, дегазации.
- Применяется средство для нелегального производства наркотиков типа метамфетаминов.
Пищевая добавка
Каустическая сода очищает овощи, фрукты от кожицы. Применяется вещество для придания цвета карамели. Как пищевая добавка E524 (класс регуляторов кислотности, веществ против комкования наряду с карбонатом натрия) используется при изготовлении какао, мороженого, сливочного масла, маргарина, шоколада, безалкогольных напитков. Оливки и маслины размягчаются, приобретают черный цвет.
Пищевые продукты – рогалики и немецкие крендели (брецели) – обрабатывают едким раствором для хрустящей корочки. В скандинавской кухне существует рыбное блюдо – лютефиск. Технология приготовления включает вымачивание на протяжении 5-6 суток сушеной трески в растворе гидроокиси, пока не будет получена желеобразная консистенция. В пищевой промышленности сода помогает рафинировать растительное масло.
В производстве моющих средств
Способность взаимодействия жиров у каустика была замечена уже давно. С VII века арабы освоили получение твердого мыла с помощью едкого натра и ароматических масел. Эта технология осталась прежней. Каустическая сода добавляется в шампуни, моющие вещества, средства личной гигиены. Косметическая промышленность применяет гидроксид Na для получения мыла против жиров, жидкости для снятия лака, кремов.
В быту
Основной способ применения – гелеобразный гидроксид или его гранулы. Входит в состав средств для устранения засоров канализации, систем отопления. Грязь растворяется, дезагрегируется и проходит дальше по трубе. Изделия из нержавеющей стали очищаются от масляных веществ с помощью каустической соды, разогретой до 50-60°С с добавлением гидроксида калия. Косметология применяет гель на его основе для размягчения ороговевшей кожи, папиллом, бородавок.

Гидроксид натрия в медицине
Соединение добавляется в лекарственные препараты против повышенной кислотности желудка, для слабительного эффекта сильного действия. Такое средство приводит к повышению перистальтики кишечника. Использование вещества восстанавливает кислотно-щелочной баланс. Применяется оно в медицине для достижения успокоительного эффекта, пригодно для очистки воды от примесей. Благодаря хлориду натрия остаются постоянными индикаторы осмотического давления плазмы крови. Не стоит путать его с пищевой содой, поваренной солью.
Вред гидроксида натрия
Вещество относится ко второму классу опасности. Из-за способности гидроокиси разъедать органические соединения применение каустика должно осуществляться с соблюдением всех мер предосторожности. При попадании щелочи на слизистые и кожу она вызывает сильные ожоги, а взаимодействие с глазами приводит к атрофии зрительного нерва. Для нейтрализации гидроксида на коже применяется слабый раствор уксуса и большое количество проточной воды.
Видео
909Была ли эта статья полезной?
Да
Нет
1 человек ответили
Спасибо, за Ваш отзыв!
человек ответили
Что-то пошло не так и Ваш голос не был учтен.
Нашли в тексте ошибку?
Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Гидроксид натрия, характеристика, свойства и получение, химические реакции
Гидроксид натрия, характеристика, свойства и получение, химические реакции.
Гидроксид натрия – неорганическое вещество, имеет химическую формулу NaOH.
Краткая характеристика гидроксида натрия
Модификации гидроксида натрия
Физические свойства гидроксида натрия
Получение гидроксида натрия
Химические свойства гидроксида натрия
Химические реакции гидроксида натрия
Применение и использование гидроксида натрия
Краткая характеристика гидроксида натрия:
Гидроксид натрия – неорганическое вещество белого цвета.
Химическая формула гидроксида натрия NaOН.
Обладает высокой гигроскопичностью. На воздухе «расплывается», активно поглощая пары воды из воздуха.
Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии. Раствор едкого натра мылок на ощупь.
Гидроксид натрия – самая распространённая щёлочь. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Гидроксид натрия – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Модификации гидроксида натрия:
До 299 оС гидроксид натрия имеет устойчивую ромбическую модификацию (a = 0,33994 нм, c = 1,1377 нм), выше 299 оС – моноклинную.
Физические свойства гидроксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaOН |
| Синонимы и названия иностранном языке | sodium hydroxide (англ.) едкий натр (рус.) натрия гидроокись (рус.) сода каустическая (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные ромбические кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2130 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,13 |
| Температура кипения, °C | 1403 |
| Температура плавления, °C | 323 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 39,997 |
* Примечание:
— нет данных.
Получение гидроксида натрия:
Гидроксид натрия получается в результате следующих химических реакций:
- 1. из оксида натрия (т.н. пиролитический метод):
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C либо нагревании до 200 °C гидрокарбонат натрия в целях получения карбоната натрия:
Na2CO3 → Na2O + CO2 (t = 1000 oC),
2NaHCO3 → Na2CO3 + CO2 + H2O (t = 200 oC), после чего проводят первую химическую реакцию.
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Na2O + H2O → 2NaOH.
- 2. путем взаимодействия раствора соды с гашеной известью (т.н. известковый метод, каустификация соды):
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH (t = 80 oC).
Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH.
- 3. ферритным методом:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2 (t = 1100-1200 oC).
Реакционную смесь спекают.
2NaFeO2 + (n+1)H2O → Fe2O3•nH2O + 2NaOH.
Реакция протекает медленно.
Fe2O3•nH2O выпадает в осадок, который после отделения его от раствора возвращается в процесс в первую реакцию.
- 4. электролизом:
2NaCl + 2H2O → 2Na2O + H2 + Cl2.
Одновременно получаются также водород и хлор.
Гидроксид натрия, водород и хлор вырабатываются тремя электрохимическими методами. Два из них – электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий – электролиз с жидким ртутным катодом (ртутный метод).
Химические свойства гидроксида натрия. Химические реакции гидроксида натрия:
Гидроксид натрия – химически активное вещество, сильное химическое основание.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4).
Химические свойства гидроксида натрия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида натрия с серой:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O (t = 50-60 °C).
В результате реакции образуются сульфид натрия, сульфит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
2. реакция гидроксида натрия с хлором:
2NaOH + Cl2 → NaCl + NaClO + H2O.
В результате реакции образуются хлорид натрия, гипохлорит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде холодного разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими галогенами.
3. реакция гидроксида натрия с алюминием:
2Al + 6NaOH → 2NaAlO2 + 3H2 + 2Na2O (t = 450 °C).
В результате реакции образуются алюминат натрия, водород и оксид натрия.
4. реакция гидроксида натрия с алюминием и водой:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2.
В результате реакции образуются тетрагидроксоалюминат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
5. реакция гидроксида натрия с цинком:
Zn + 2NaOH → Na2ZnO2 + H2 (t = 550 °C).
В результате реакции образуются цинкат натрия и водород.
6. реакция гидроксида натрия с цинком и водой:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2.
В результате реакции образуются тетрагидроксоцинкат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
7. реакция гидроксида натрия с ортофосфорной кислотой:
H3PO4 + NaOH → NaH2PO4 + H2O.
В результате реакции образуются дигидроортофосфат натрия и вода. При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид натрия в виде разбавленного раствора.
8. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
9. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими кислотами.
10. реакция гидроксида натрия с сероводородом:
H2S + 2NaOH → Na2S + 2H2O,
H2S + NaOH → NaHS + H2O.
В результате реакции образуются в первом случае – сульфид натрия и вода, во втором – гидросульфид натрия и вода. При этом гидроксид натрия в первом случае в качестве исходного вещества используется в виде концентрированного раствора, во втором случае – в виде разбавленного раствора.
11. реакция гидроксида натрия с фтороводородом:
HF + NaOH → NaF + H2O,
2HF + NaOH → NaHF2 + H2O.
В результате реакции образуются в первом случае – фторид натрия и вода, во втором – гидрофторид натрия и вода. При этом гидроксид натрия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае фтороводород используется в виде в виде концентрированного раствора.
12. реакция гидроксида натрия с бромоводородом:
HBr + NaOH → NaBr + H2O.
В результате реакции образуются бромид натрия и вода. При этом гидроксид натрия и бромоводород в качестве исходного вещества используются в виде разбавленного раствора.
13. реакция гидроксида натрия с йодоводородом:
HI + NaOH → NaI + H2O.
В результате реакции образуются йодид натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
14. реакция гидроксида натрия с оксидом цинка:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуются цинкат натрия и вода.
15. реакция гидроксида натрия с оксидом цинка и водой:
ZnO + NaOH + H2O → Na[Zn(OH)3] (t = 100 °C),
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (t = 90 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуется в первом случае – тригидроксоцинкат натрия и вода, во втором случае – тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в первом случае в виде 40 % разбавленного раствора, во втором – в виде 60 % разбавленного раствора.
16. реакция гидроксида натрия с оксидом алюминия:
Al2O3 + 2NaOH → 2NaAlO2 + H2O (t = 900-1100 °C).
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат натрия и вода.
17. реакция гидроксида натрия с оксидом алюминия и водой:
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6],
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4].
Оксид алюминия является амфотерным оксидом. В результате реакции образуется в первом случае – гексагидроксоалюминат натрия, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного горячего раствора.
18. реакция гидроксида натрия с оксидом железа:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O (t = 600 °C, р).
Оксид железа является амфотерным оксидом. В результате реакции образуются феррит натрия и вода. Реакция происходит при сплавлении исходных веществ.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными оксидами.
19. реакция гидроксида натрия с оксидом углерода (углекислым газом):
NaOH + CO2 → NaHCO3.
В результате реакции образуется гидрокарбонат натрия.
20. реакция гидроксида натрия с оксидом серы:
SO2 + NaOH → NaHSO3.
В результате реакции образуется гидросульфит натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
21. реакция гидроксида натрия с оксидом кремния:
2NaOH + SiO2 → Na2SiO3 + H2O (t = 900-1000 °C),
4NaOH + SiO2 → Na4SiO4 + 2H2O.
В результате реакции образуется в первом случае – силикат натрия и вода, во втором случае – ортосиликат натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
22. реакция гидроксида натрия с гидроксидом алюминия:
Al(OH)3 + NaOH → NaAlO2 + 2H2O (t = 1000 °C),
Al(OH)3 + NaOH → Na[Al(OH)4].
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат натрия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
23. реакция гидроксида натрия с гидроксидом цинка:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4].
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
24. реакция гидроксида натрия с гидроксидом железа:
Fe(OH)3 + 3NaOH ⇄ Na3[Fe(OH)6].
Гидроксид железа является амфотерным основанием. В результате реакции образуется гексагидроксоферрат натрия.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными гидроксидами.
25. реакция гидроксида натрия с сульфатом железа:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (kat = N2).
В результате реакции образуются гидроксид железа и сульфат натрия.
26. реакция гидроксида натрия с хлоридом меди:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
В результате реакции образуются гидроксид меди и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
27. реакция гидроксида натрия с нитратом свинца:
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3.
В результате реакции образуются гидроксид свинца и нитрат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
28. реакция гидроксида натрия с хлоридом алюминия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
В результате реакции образуются гидроксид алюминия и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими солями.
Применение и использование гидроксида натрия:
Гидроксид натрия используется во множестве отраслей промышленности и для бытовых нужд:
– в целлюлозно-бумажной промышленности для делигнификации(сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит;
– для омыления жиров при производстве мыла, шампуня и других моющих средств;
– в химических отраслях промышленности – для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке – для производства масел;
– для изготовления биодизельного топлива – получаемого из растительных масел и используемого для замены обычного дизельного топлива.
Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число – условная количественная характеристика самовоспламеняемости дизельныхтоплив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности;
– в качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе;
– в текстильной промышленности – для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск;
– в приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524;
– в фотографии – как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
гидроксид натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида натрия
реакции с оксидом натрия колледж пермь
Коэффициент востребованности 8 389
Гидроксид натрия — распространенная и полезная щелочь
Данный реактив, самая распространенная щелочь, более известен 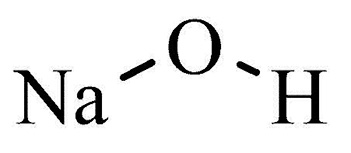 под названиями едкий натр или каустическая сода (от французского слова sodium — натрий и греческого слова kaustikos — едкий). Исходя из названия понятно, что вещество опасное, поэтому обращаться с ним надо бережно. Гидроокись натрия — бесцветная кристаллическая масса. Вещество способно разъедать не только материалы органического происхождения, но и определенные металлы, причем при контакте с цинком, свинцом, алюминием, оловом и их сплавами выделяется водород, взрывоопасный газ. Нельзя допускать контакта каустической соды с аммиаком, это пожароопасно.
под названиями едкий натр или каустическая сода (от французского слова sodium — натрий и греческого слова kaustikos — едкий). Исходя из названия понятно, что вещество опасное, поэтому обращаться с ним надо бережно. Гидроокись натрия — бесцветная кристаллическая масса. Вещество способно разъедать не только материалы органического происхождения, но и определенные металлы, причем при контакте с цинком, свинцом, алюминием, оловом и их сплавами выделяется водород, взрывоопасный газ. Нельзя допускать контакта каустической соды с аммиаком, это пожароопасно.
Важные особенности гидроксида натрия
Их важно знать, чтобы работа с этим реактивом была безопасной, и чтобы его применение принесло ожидаемые результаты.
- — Как и другие щелочи, этот химикат является сильным основанием, которые, как известно, отлично растворяются в воде, что сопровождается сильным выделением тепла.
- — Гидроокись натрия может буквально растворяться, находясь на воздухе, так как невероятно гигроскопична и вбирает влагу из окружающей среды. Это значит, что хранить ее необходимо в плотно укупоренной таре и в сухом помещении. Иногда ее хранят в виде раствора в воде, этиле или метаноле.
- — Горячий раствор или расплавленный реактив нежелательно помещать в емкости из стекла или фарфора — это может повредить их, поскольку каустик вступает в реакцию с кремнеземом в их составе. Лучше для гидроксида натрия купить емкость из полиэтилена, поливинилхлорида или резины.
Основные сферы применения едкого натра
- — Мыловарение, производство бумаги и картона, косметики, растворителей, биодизельного топлива и минеральных масел.
- — Обработка древесины, нейтрализация ядовитых газов и кислот.
- — В медицине: удаление ороговевшей кожи и папиллом, лечение бородавок.
- — В качестве чистящего и дезинфицирующего средства, в химической промышленности в качестве катализатора.
- — В пищевой промышленности, в частности для придания темного окраса и мягкости оливкам, для получения хрустящей корочки на выпечке, при изготовлении какао.
Техника безопасности в работе с гидроксидом натрия
По ГОСТ 12.1.007-76 каустическая сода относится ко II классу токсичности (высокоопасна). Может вызвать сильный ожог кожи и слизистых, необратимое повреждение зрения при попадании в глаза. Именно поэтому работать с ней нужно в перчатках и защитных очках, использовать специальную одежду с виниловой пропиткой или прорезиненную. 
При попадании вещества на слизистую ее как можно скорее нужно промыть большим количеством проточной воды, кожу промыть слабым раствором уксуса.
При большой поверхности ожога, при попадании реактива внутрь или в глаз следует не только приянть эти меры, но и незамедлительно обратиться к врачу.
Вы можете купить щелочь гидроксид натрия в нашем магазине, и мы надеемся, что вы будете соблюдать технику безопасности. Товар продается с доставкой, поэтому вы можете купить щелочь в Москве или другом городе России и вскоре получить его в своем городе.
Растворение гидроксида натрия в воде. Гидроксид натрия
Гидроксид натрия — едкое и коррозионно-активное вещество. Гидроксид натрия — белое твёрдое вещество. Химический ожог в результате действия раствора гидроксида натрия. В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция.
К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей. Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100-1200 °С. При этом образуется спек — феррит натрия и выделяется двуокись углерода.
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза. Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия. Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок.
Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. В ряду электрохимических методов получения щёлоков самым эффективным способом является электролиз с ртутным катодом. Ртуть почти полностью освобождается от натрия и возвращается в электролизер.
При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности, либо перерабатывается в эпихлоргидрин по методу Solvay.
Использование гидроксида натрия (NaOH) в быту
Едкий натр – это твердое вещество белого или желтоватого цвета, немного скользкое на ощупь, которое получают путем электролиза из хлорида натрия. Натрия гидроксид является сильной щелочью, которая способна разрушать органические вещества: бумагу, дерево, а также кожу человека, вызывая ожоги различной степени тяжести.
Промышленность выпускает гидроокись натрия в виде белого рассыпчатого порошка без запаха. Технический едкий натр может поставляться в виде различных растворов: ртутных, химических, диафрагменных. В расплавленном виде может разрушать фарфор и стекло.
1 комментарий к записи “Использование гидроксида натрия (NaOH) в быту”
Достаточно широко гидроокись натрия применяется в косметической промышленности. ГИДРОКСИД НАТРИЯ (каустическая сода, NaOH). Сильная щелочь, вырабатываемая в промышленных масштабах путем электролиза из соли, хлорида натрия (NaCl). Поглощает также содержащийся в атмосфере углекислый газ и образовывает корку из карбоната натрия.
В 1787 году врач Никола Леблан разработал удобный метол получения гидроксида натрия из хлористого натрия. В настоящее время гидроксид натрия чаще всего получают путем электролиза солевых растворов. Гидроокись натрия – невероятно популярное и широко используемое химическое соединение. Каустическая сода используется в фармацевтической, химической, пищевой промышленности, а также в косметической и текстильной.
В пищевой промышленности гидроокись натрия используется как регулятор кислотности, препятствующий комкованию и слеживанию. Ожоги от гидроксида натрия очень медленно заживают, оставляя рубцы. Попадание вещества в глаза чаще всего приводит к потере зрения. Все работы с гидроокисью натрия надо проводить в защитных очках и в спецодежде. Все из той же статистики, можно сделать вывод относительно того, что гидроксид натрия пользуется большим спросом.
Вред пищевого эмульгатора Е524 Гидроксид натрия
Используется для того чтобы нейтрализовать кислоты и кислотные окислы, в качестве катализатора или реагента. Участвует в производстве чистых металлов и для травления алюминия. Можно встретить его и в лабораториях, где его применяют для титрования. Изготовление топлива (биодизельного). Этот вид топлива получают из растительных масел и используют для альтернативной замены широко известного
Гидроксид натрия Википедия
Гидроксид натрия 
({{{картинка3D}}})  (
({{{изображение}}}) Общие Систематическое
наименование Гидроксид натрия Традиционные названия едкий натр; гидроокись натрия; каустик; аскарит;
каустическая сода;
едкая щёлочь Хим. формула NaOH Рац. формула NaOH Физические свойства Молярная масса 39,997 г/моль Плотность 2,13 г/см³ Термические свойства Температура • плавления 323 °C • кипения 1403 °C Давление пара 0 ± 1 мм рт.ст.[1] Химические свойства Растворимость • в воде 108,7 г/100 мл Классификация Рег. номер CAS 1310-73-2 PubChem 14798 Рег. номер EINECS 215-185-5 SMILES
[OH-].[Na+]InChI
1S/Na.h3O/h;1h3/q+1;/p-1HEMHJVSKTPXQMS-UHFFFAOYSA-Mекс Алиментариус E524 RTECS WB4900000 ChEBI 32145 Номер ООН 1823 ChemSpider 14114 Безопасность
гидроксид натрия — со всех языков на все языки
См. также в других словарях:
Гидроксид натрия — Гидроксид натрия … Википедия
ГИДРОКСИД НАТРИЯ — (каустическая сода, NaOH). Сильная щелочь, вырабатываемая в промышленных масштабах путем электролиза из соли, хлорида натрия (NaCl). Это белое твердое вещество, которое при попадании на кожу создает ожог, слегка скользкое на ощупь, поскольку оно… … Научно-технический энциклопедический словарь
ГИДРОКСИД НАТРИЯ — едкий натр, каустическая сода, каустик, NaOH бесцветная кристаллическая масса; плотностью 2130 кг/м3; tпл=320° С; растворимость в воде при 20° С 52,2%. Сильная щелочь, вызывающая ожоги на коже человека. Гидроксид натрия применяют для… … Металлургический словарь
Гидроксид натрия (сода каустическая) — Гидроксид натрия получают, например, каустификацией карбоната натрия известковым молоком или электролизом хлорида натрия. Он может находиться как в водном растворе, так и в безводном твердом состоянии. При выпаривании водного раствора гидроксида… … Официальная терминология
Натрия гидроксид — Гидроксид натрия [править] Наименование едкий натр, каустик, каустическая сода, едкая щелочь Химическая формула Na OH Молярная масса 39.9971 г/моль … Википедия
Гидроксид рубидия — Общие Систематическое наименование Гидроксид рубидия Традиционные названия едкая щёлочь едкий рубит Химическая формула RbOH Физические свойства Молярная масса 102,407 … Википедия
Гидроксид калия (едкое кали) — Гидроксид калия обычно получают электролизом растворов природного хлорида калия (товарная позиция 3104), но он может быть получен также каустификацией карбоната калия известковым молоком (образующим известковый поташ ). Чистый гидроксид калия… … Официальная терминология
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия Nah3PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия
Гидроксид марганца(II) — Общие Систематическое наименование Гидроксид марганца(II) Традиционные названия Гидроокись марганца Химическая формула Mn(OH)2 Физические свойства … Википедия
Натрия гидроксид — получение, свойства, вред
 Гидроксид натрия (пищевая добавка Е524, едкий натр, гидроокись натрия, каустическая сода) – твердая сплавленная масса желтоватого или белого цвета. По своим химическим свойствам гидроксид натрия относится к сильной щелочи.
Гидроксид натрия (пищевая добавка Е524, едкий натр, гидроокись натрия, каустическая сода) – твердая сплавленная масса желтоватого или белого цвета. По своим химическим свойствам гидроксид натрия относится к сильной щелочи.
Общие свойства гидроксида натрия
Едкий натр обычно выпускается в виде прозрачного бесцветного раствора или в виде пасты.
Каустическая сода отлично растворяется в воде, выделяя тепло. При взаимодействии с воздухом это вещество расплывается, поэтому в продажу оно поступает в герметически закрытой таре. В природных условиях гидроокись натрия входит в состав минерала брусита. Температура кипения гидроокиси натрия составляет 1390 °C, температура плавления – 322 °C.
Получение гидроксида натрия
В 1787 году врач Никола Леблан разработал удобный метол получения гидроксида натрия из хлористого натрия. Позднее метод Леблана был вытеснен электролитическим способом получения едкого натра. В 1882 году был разработан ферритный способ получения гидроксида натрия, основанный на использовании кальцинированной соды.
В настоящее время гидроксид натрия чаще всего получают путем электролиза солевых растворов. Ферритный способ получения каустической соды сейчас используется достаточно редко.
Применение гидроксида натрия
Гидроокись натрия – невероятно популярное и широко используемое химическое соединение. Ежегодно производится около семидесяти миллионов тонн едкого натра.
Каустическая сода используется в фармацевтической, химической, пищевой промышленности, а также в косметической и текстильной. Едкий натр применяют при изготовлении синтетического фенола, глицерина, органических красителей, лекарственных препаратов. Данное соединение может нейтрализовать содержащиеся в воздухе вредные для организма человека компоненты. Поэтому растворы гидроксида натрия нередко используют для дезинфекции помещений.
 В пищевой промышленности гидроокись натрия используется как регулятор кислотности, препятствующий комкованию и слеживанию. Пищевая добавка Е524 поддерживает необходимую консистенцию продуктов при производстве маргарина, шоколада, мороженого, сливочного масла, карамели, желе, джема.
В пищевой промышленности гидроокись натрия используется как регулятор кислотности, препятствующий комкованию и слеживанию. Пищевая добавка Е524 поддерживает необходимую консистенцию продуктов при производстве маргарина, шоколада, мороженого, сливочного масла, карамели, желе, джема.
Хлебобулочные изделия перед выпечкой обрабатывают раствором каустической соды для получения темно-коричневой хрустящей корочки. Кроме того, пищевую добавку Е524 применяют для рафинирования растительного масла.
Вред гидроксида натрия
Едкий натр – токсичное вещество, разрушающее слизистую оболочку и кожные покровы. Ожоги от гидроксида натрия очень медленно заживают, оставляя рубцы. Попадание вещества в глаза чаще всего приводит к потере зрения. При попадании щелочи на кожные покровы следует промыть пораженные области струей воды. При попадании внутрь организма едкий натр вызывает ожоги гортани, полости рта, желудка и пищевода.
Все работы с гидроокисью натрия надо проводить в защитных очках и в спецодежде.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Знаете ли вы, что:В Великобритании есть закон, согласно которому хирург может отказаться делать пациенту операцию, если он курит или имеет избыточный вес. Человек должен отказаться от вредных привычек, и тогда, возможно, ему не потребуется оперативное вмешательство.
В нашем кишечнике рождаются, живут и умирают миллионы бактерий. Их можно увидеть только при сильном увеличении, но, если бы они собрались вместе, то поместились бы в обычной кофейной чашке.
Согласно мнению многих ученых, витаминные комплексы практически бесполезны для человека.
Желудок человека неплохо справляется с посторонними предметами и без врачебного вмешательства. Известно, что желудочный сок способен растворять даже монеты.
Каждый человек имеет не только уникальные отпечатки пальцев, но и языка.
Многие наркотики изначально продвигались на рынке, как лекарства. Героин, например, изначально был выведен на рынок как лекарство от детского кашля. А кокаин рекомендовался врачами в качестве анестезии и как средство повышающее выносливость.
Согласно исследованиям, женщины, выпивающие несколько стаканов пива или вина в неделю, имеют повышенный риск заболеть раком груди.
Во время работы наш мозг затрачивает количество энергии, равное лампочке мощностью в 10 Ватт. Так что образ лампочки над головой в момент возникновения интересной мысли не так уж далек от истины.
Во время чихания наш организм полностью прекращает работать. Даже сердце останавливается.
Стоматологи появились относительно недавно. Еще в 19 веке вырывать больные зубы входило в обязанности обычного парикмахера.
Большинство женщин способно получать больше удовольствия от созерцания своего красивого тела в зеркале, чем от секса. Так что, женщины, стремитесь к стройности.
В стремлении вытащить больного, доктора часто перегибают палку. Так, например, некий Чарльз Йенсен в период с 1954 по 1994 гг. пережил более 900 операций по удалению новообразований.
Вес человеческого мозга составляет около 2% от всей массы тела, однако потребляет он около 20% кислорода, поступающего в кровь. Этот факт делает человеческий мозг чрезвычайно восприимчивым к повреждениям, вызванным нехваткой кислорода.
Американские ученые провели опыты на мышах и пришли к выводу, что арбузный сок предотвращает развитие атеросклероза сосудов. Одна группа мышей пила обычную воду, а вторая – арбузный сок. В результате сосуды второй группы были свободны от холестериновых бляшек.
Общеизвестный препарат «Виагра» изначально разрабатывался для лечения артериальной гипертонии.
гидроксид натрия | Применение, преимущества и факты химической безопасности
Использование и преимущества
Гидроксид натрия используется для производства многих повседневных товаров, таких как бумага, алюминий, средства для чистки промышленных сточных вод и духовок, а также мыло и моющие средства.
Гидроксид натрия в чистящих и дезинфицирующих средствах
Гидроксид натрия используется для производства мыла и различных моющих средств, используемых в быту и в коммерческих целях. Хлорный отбеливатель получают путем объединения хлора и гидроксида натрия.Очистители канализации, содержащие гидроксид натрия, превращают жиры и жир, которые могут засорить трубы, в мыло, растворяющееся в воде.
Гидроксид натрия в фармацевтике и медицине
Гидроксид натрия используется для производства различных лекарств и фармацевтических продуктов, от обычных болеутоляющих, таких как аспирин, до антикоагулянтов, которые могут помочь предотвратить образование тромбов, до лекарств, снижающих уровень холестерина.
Гидроксид натрия в энергетике
В энергетическом секторе гидроксид натрия используется в производстве топливных элементов.Топливные элементы работают как батареи, чтобы чисто и эффективно производить электроэнергию для различных целей, включая транспорт; погрузочно-разгрузочные работы; стационарные, портативные и аварийные источники резервного питания. Эпоксидные смолы, изготовленные из гидроксида натрия, используются в ветряных турбинах.
Гидроксид натрия в очистке воды
Муниципальные водоочистные сооружения используют гидроксид натрия для контроля кислотности воды и удаления тяжелых металлов из воды. Гидроксид натрия также используется для производства гипохлорита натрия, дезинфицирующего средства для воды.
Гидроксид натрия в производстве пищевых продуктов
Гидроксид натрия используется в нескольких приложениях пищевой промышленности, таких как консервирование таких продуктов, как оливки, или помощь в поджаривании кренделей в баварском стиле, придавая им характерный хруст. Гидроксид натрия используется для удаления кожуры с помидоров, картофеля и других фруктов и овощей для консервирования, а также в качестве ингредиента пищевых консервантов, которые помогают предотвратить рост плесени и бактерий в пище.
Гидроксид натрия в изделиях из дерева и бумаги
Во многих процессах производства бумаги древесину обрабатывают раствором, содержащим сульфид натрия и гидроксид натрия.Это помогает растворить большую часть нежелательного материала в древесине, оставляя относительно чистую целлюлозу, которая составляет основу бумаги. В процессе переработки бумаги гидроксид натрия используется для отделения чернил от бумажных волокон, позволяя повторно использовать бумажные волокна.
Гидроксид натрия также используется для очистки сырья для деревянных изделий, таких как шкафы и мебель, а также для отбеливания и очистки древесины.
Гидроксид натрия при переработке алюминиевой руды
Гидроксид натрия используется для извлечения глинозема из природных минералов.Глинозем используется для производства алюминия и различных продуктов, включая фольгу, банки, кухонную утварь, пивные бочонки и детали самолетов. В строительстве алюминий используется в материалах, которые используются для изготовления фасадов зданий и оконных рам.
Гидроксид натрия в других промышленных производствах.
Гидроксид натрия используется во многих других промышленных и производственных процессах. Он используется для производства вискозы, спандекса, взрывчатых веществ, эпоксидных смол, красок, стекла и керамики. Он также используется в текстильной промышленности для изготовления красок, обработки хлопчатобумажных тканей, стирки и отбеливания, а также для очистки и обработки металлов, нанесения оксидных покрытий, гальваники и электролитического извлечения.
. Завод по производству гидроксида соды, производственная компания OEM / ODM по производству гидроксида соды
Всего найдено 161 фабрика и компания по производству гидроксида соды с 483 продуктами. Получите высококачественную гидроксидную соду из нашего огромного выбора надежных заводов по производству гидроксидной соды.
Золотой член Тип бизнеса: Торговая компания Основные продукты: Каустик Сода , Каустик Сода Жемчуг, Каустик Сода Хлопья, 99% натрия Гидроксид , Карбид кальция Mgmt.Сертификация: ISO 9001, ISO 9000, QC 080000
Собственность завода: Общество с ограниченной ответственностью Объем НИОКР: OEM, собственный бренд Расположение: Тяньцзинь, Тяньцзинь
Золотой член Тип бизнеса: Торговая компания Основные продукты: Гипохлорит кальция, TCCA и SDIC, хлорит натрия, диоксид титана, этанол Mgmt.Сертификация: ISO 9001, ISO 9000, ISO 20000
Собственность завода: Общество с ограниченной ответственностью Объем НИОКР: OEM, ODM Расположение: Чжэнчжоу, Хэнань
Золотой член Тип бизнеса: Производитель / Завод
, Торговая компания
, Group Corporation Основные продукты: Стальная конструкция, изделия из стали и железа, химикаты, строительные материалы, светодиодные фонари Mgmt.Сертификация: ISO 9001, ISO 9000
Собственность завода: Общество с ограниченной ответственностью Объем НИОКР: OEM Расположение: Гуанчжоу, Гуандун
Золотой член Тип бизнеса: Торговая компания Основные продукты: Смола ПВХ, диоксид титана, SLES, LABSA, оксид железа Mgmt.Сертификация: ISO 9001, OHSAS / OHSMS 18001, IATF16949, HSE, GMP …
Собственность завода: Общество с ограниченной ответственностью Расположение: Чжэнчжоу, Хэнань Производственные линии: Больше 10
Золотой член Тип бизнеса: Торговая компания Основные продукты: Серная кислота, соляная кислота, азотная кислота, перекись водорода, каустическая кислота Сода Жидкость Mgmt.Сертификация: ISO 9001, ISO 14000
Собственность завода: Общество с ограниченной ответственностью Объем НИОКР: Собственный бренд Расположение: Шицзячжуан, Хэбэй
Золотой член Тип бизнеса: Торговая компания Основные продукты: Органические химические вещества, неорганические химические вещества Mgmt.Сертификация: ISO 9001, ISO 9000, ISO 20000
Собственность завода: Общество с ограниченной ответственностью Объем НИОКР: OEM Расположение: Вэйфан, Шаньдун
Золотой член Тип бизнеса: Торговая компания Основные продукты: Мочевина, сульфат аммония, удобрение NPK, удобрение DAP, гексамин Mgmt.Сертификация: ISO 9001, ISO 14000
Собственность завода: Общество с ограниченной ответственностью Объем НИОКР: OEM, собственный бренд Расположение: Цзинань, Шаньдун
. Поставщик щелока (гидроксид натрия) | Оптовая аптека
Купите щелок в оптовой аптеке. Мы являемся одним из крупнейших производителей и поставщиков чистого щелока (гидроксида натрия). Щелок, также известный как каустическая сода, используется для создания мыла, моющих средств, бумаги, текстильных изделий и питьевой воды. Это химическая основа, упакованная в белое твердое вещество.

Поставщик щелока (гидроксид натрия)
Наш чистый щелок гидроксида натрия имеет бесчисленное множество применений и соответствует требованиям пищевого кодекса.Кроме того, мы предлагаем его по самым низким ценам в Интернете. Если вы найдете где-нибудь в Интернете более выгодную цену на чистый гидроксид натрия, сообщите нам, и мы сделаем все возможное, чтобы превзойти эту цену. *** Этот товар может быть доставлен только UPS Ground или LTL из-за того, что он является опасным материалом. *** В связи с опасностью этого продукта взрослый должен расписаться на упаковке при ее доставке . *** Важное примечание: имейте в виду, что, нажимая кнопку заказа ниже, вы соглашаетесь с тем, что вам больше 18 лет и вы используете LYE для изготовления мыла или другого законного использования.Мы ведем полный учет того, где мы продаем гидроксид натрия, и полностью сотрудничаем с местными и федеральными властями, когда к нам обращаются. Также обратите внимание, что приведенная ниже информация предназначена только для исследовательских целей, и мы настоятельно рекомендуем никому не использовать щелок на основании информации ниже. Работать с этим продуктом очень опасно, поэтому перед использованием следует соблюдать все меры предосторожности. ДЕРЖАТЬ ОТ ДЕТЕЙ. ЛЖА МОЖЕТ ПРИВЕСТИ К СЕРЬЕЗНЫМ ХИМИЧЕСКИМ ОЖОГАМ И ДАЖЕ СМЕРТИ, ПРИ НЕПРАВИЛЬНОМ ОБРАЩЕНИИ!
Щелок — использование и преимущества гидроксида натрия
Неудивительно, что в 2004 году мир произвел 60 миллионов метрических тонн гидроксида натрия, став невероятно универсальным и полезным ингредиентом во всем, от приготовления пищи до очистки канализации.Краткий обзор множества вариантов использования включает:

Еда — его можно использовать для мытья или химической очистки фруктов и овощей. Кроме того, его часто используют для смягчения таких продуктов, как оливки или выпечка.
Очистка — В жидком виде используется для очистки сточных вод, растворения металлов и удаления краски с поверхности. Его также можно использовать для обезжиривания посуды из нержавеющей стали и стекла.
Волосы — В жидкой форме он смешивается с другими ингредиентами для создания средства для выпрямления волос (часто называемого «расслабляющим средством»).
Ткань — часто используется для растворения тканей, в частности, для разрушения тканей мертвых животных при удалении туш.
Бумага — ключевой ингредиент в создании бумаги из древесной массы.
Мыло — Обычно для производства мыла холодным способом необходим щелок. Его также можно использовать в мыловарении горячим способом при смешивании с соответствующими жирами и маслами. Каустическая сода (щелок) вызывает химическую реакцию, известную как омыление. Этот процесс расщепляет масла и превращает их в мыло.
История щелока
Древние египтяне и вавилоняне использовали форму щелока (с использованием золы) около 4800 лет назад и записали ее использование на глиняной табличке. На протяжении большей части истории вода пропускалась через древесную золу, а затем смешивалась с животными жирами в примитивной попытке изготовления мыла. Щелок не был полностью идентифицирован и понят до тех пор, пока сэр Хэмфри Дэви не обнаружил его в 1807 году. Сначала полагая, что он был одним из основных элементов; Позже он открыл натрий.
Термин «щелочь» — это старое английское слово, означающее «стирать вещи».Оригинальное щелочное мыло было очень жестким и часто оставляло кожу пользователя красной после использования. Это произошло потому, что было использовано слишком много щелока по сравнению с количеством масел. Слишком маленькое количество может привести к прогорклости масла в мыле и неприятного запаха. Когда вы найдете хороший рецепт для изготовления мыла, обязательно придерживайтесь его.
Мыловарение
Жиры и масла сами по себе не смешиваются с водой. Щелочной раствор гидроксида натрия расщепляет триглицериды жиров и масел и превращает жирные кислоты в соли натрия.Соли снижают поверхностное натяжение жидкостей и позволяют легко смывать жир водой. Попробуйте приготовить чистое мыло без отдушек, отдушек, красителей и добавок, которые могут раздражать вашу кожу. Использование чистого мыла, содержащего только глицерин, может очистить и улучшить состояние вашей кожи — независимо от того, что это за состояние. Чистое щелочное мыло успокаивает укусы насекомых и фактически отпугивает насекомых своим остатком. Попробуйте сбрить щелочное мыло и использовать его в качестве стирального порошка или потрите брусок прямо на проблемное пятно.Было установлено, что щелочное мыло столь же эффективно, как и коммерческие продукты, представленные на рынке.
Полезно разрушительное
Использование силы щелока может быть очень полезным для находчивого человека. Те же свойства, которые превращают масло и жиры в мыло, можно использовать для растворения жира и волос, которые замедляются (или полностью забивают сток). Выложите столовую ложку с горкой в медленно работающий дренаж и медленно добавьте столько воды, чтобы она растворилась. Не забудьте обеспечить достаточную вентиляцию, оставьте на 10 минут, а затем промойте горячей водой в течение нескольких минут, чтобы очистить трубы.
Смешайте одну (1) чашку щелока, одну (1) чашку кукурузного крахмала и два (2) галлона воды, чтобы получилось эффективное средство для снятия краски. Поэкспериментируйте, чтобы придать окрашенным предметам рустикальный или потрепанный вид.
Приготовьте традиционные мягкие крендели, купая их в одной (1) литре воды с одной (1) унцией гидроксида натрия, смешанной в течение тридцати секунд. Готовый продукт будет темно-коричневым, мягким и вкусным. Лучшие рогалики так же варят в растворе щелочи, делая их мягкими и жевательными.Во многих рецептах пытаются заменить гидроксид натрия пищевой содой, но рецензенты сходятся во мнении, что «щелочная ванна» дает гораздо лучшие результаты.
Опасности щелока
Убедитесь, что вы знаете, что вы вкладываете в свое тело. Хотя его обычно продают в хозяйственных магазинах как очиститель канализации, его также можно смешивать с другими химическими веществами, которые не обязательно добавлять в еду или мыло. Не доверяйте продукту, предназначенному для очистки сточных вод, только , чтобы сделать что-то, что вы планируете наносить на свое тело.Наш продукт на 100% чист, и вы можете быть уверены, что используете только лучшие ингредиенты.
Заявление об ограничении ответственности :
Гидроксид натрия, или щелочь, очень сильный и едкий ингредиент. Это то, с чем следует обращаться с особой осторожностью . Мы рекомендуем находиться под присмотром и использовать соответствующие защитные средства (например, перчатки, защитные очки, респираторы и т. Д.) При использовании. Этот продукт необходимо хранить Вдали от детей .Убедитесь, что у вас нет аллергии на продукт и вы используете чистые ингредиенты. Беременным женщинам перед работой следует проконсультироваться с врачом.
Этот продукт не может быть ускорен и должен быть доставлен наземным транспортом в соответствии с требованиями Министерства транспорта. Едкие вещества (гидроксид натрия, гидроксид калия) относятся к классу опасности VIII и могут транспортироваться только наземным транспортом.
.
(
{{{картинка3D}}}) (
({{{изображение}}})наименование
каустическая сода;
едкая щёлочь
[OH-].[Na+]
1S/Na.h3O/h;1h3/q+1;/p-1HEMHJVSKTPXQMS-UHFFFAOYSA-M
Гидроксид натрия — Гидроксид натрия … Википедия
ГИДРОКСИД НАТРИЯ — (каустическая сода, NaOH). Сильная щелочь, вырабатываемая в промышленных масштабах путем электролиза из соли, хлорида натрия (NaCl). Это белое твердое вещество, которое при попадании на кожу создает ожог, слегка скользкое на ощупь, поскольку оно… … Научно-технический энциклопедический словарь
ГИДРОКСИД НАТРИЯ — едкий натр, каустическая сода, каустик, NaOH бесцветная кристаллическая масса; плотностью 2130 кг/м3; tпл=320° С; растворимость в воде при 20° С 52,2%. Сильная щелочь, вызывающая ожоги на коже человека. Гидроксид натрия применяют для… … Металлургический словарь
Гидроксид натрия (сода каустическая) — Гидроксид натрия получают, например, каустификацией карбоната натрия известковым молоком или электролизом хлорида натрия. Он может находиться как в водном растворе, так и в безводном твердом состоянии. При выпаривании водного раствора гидроксида… … Официальная терминология
Натрия гидроксид — Гидроксид натрия [править] Наименование едкий натр, каустик, каустическая сода, едкая щелочь Химическая формула Na OH Молярная масса 39.9971 г/моль … Википедия
Гидроксид рубидия — Общие Систематическое наименование Гидроксид рубидия Традиционные названия едкая щёлочь едкий рубит Химическая формула RbOH Физические свойства Молярная масса 102,407 … Википедия
Гидроксид калия (едкое кали) — Гидроксид калия обычно получают электролизом растворов природного хлорида калия (товарная позиция 3104), но он может быть получен также каустификацией карбоната калия известковым молоком (образующим известковый поташ ). Чистый гидроксид калия… … Официальная терминология
Натрия карбонат — Карбонат натрия Общие Систематическое наименование карбонат натрия Традиционные названия кальцинированная сода Химическая формула Na2C … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия Nah3PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия
Гидроксид марганца(II) — Общие Систематическое наименование Гидроксид марганца(II) Традиционные названия Гидроокись марганца Химическая формула Mn(OH)2 Физические свойства … Википедия
 Гидроксид натрия (пищевая добавка Е524, едкий натр, гидроокись натрия, каустическая сода) – твердая сплавленная масса желтоватого или белого цвета. По своим химическим свойствам гидроксид натрия относится к сильной щелочи.
Гидроксид натрия (пищевая добавка Е524, едкий натр, гидроокись натрия, каустическая сода) – твердая сплавленная масса желтоватого или белого цвета. По своим химическим свойствам гидроксид натрия относится к сильной щелочи. В пищевой промышленности гидроокись натрия используется как регулятор кислотности, препятствующий комкованию и слеживанию. Пищевая добавка Е524 поддерживает необходимую консистенцию продуктов при производстве маргарина, шоколада, мороженого, сливочного масла, карамели, желе, джема.
В пищевой промышленности гидроокись натрия используется как регулятор кислотности, препятствующий комкованию и слеживанию. Пищевая добавка Е524 поддерживает необходимую консистенцию продуктов при производстве маргарина, шоколада, мороженого, сливочного масла, карамели, желе, джема.ISO 9001, ISO 9000, QC 080000
ISO 9001, ISO 9000, ISO 20000
ISO 9001, ISO 9000
ISO 9001, OHSAS / OHSMS 18001, IATF16949, HSE, GMP …
ISO 9001, ISO 14000
ISO 9001, ISO 9000, ISO 20000
ISO 9001, ISO 14000

