Примеры жидких веществ. Газообразное, жидкое и твердое состояния вещества
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ — это природные обитатели, формирующиеся естественным путем. Другая половина — искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.
Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма.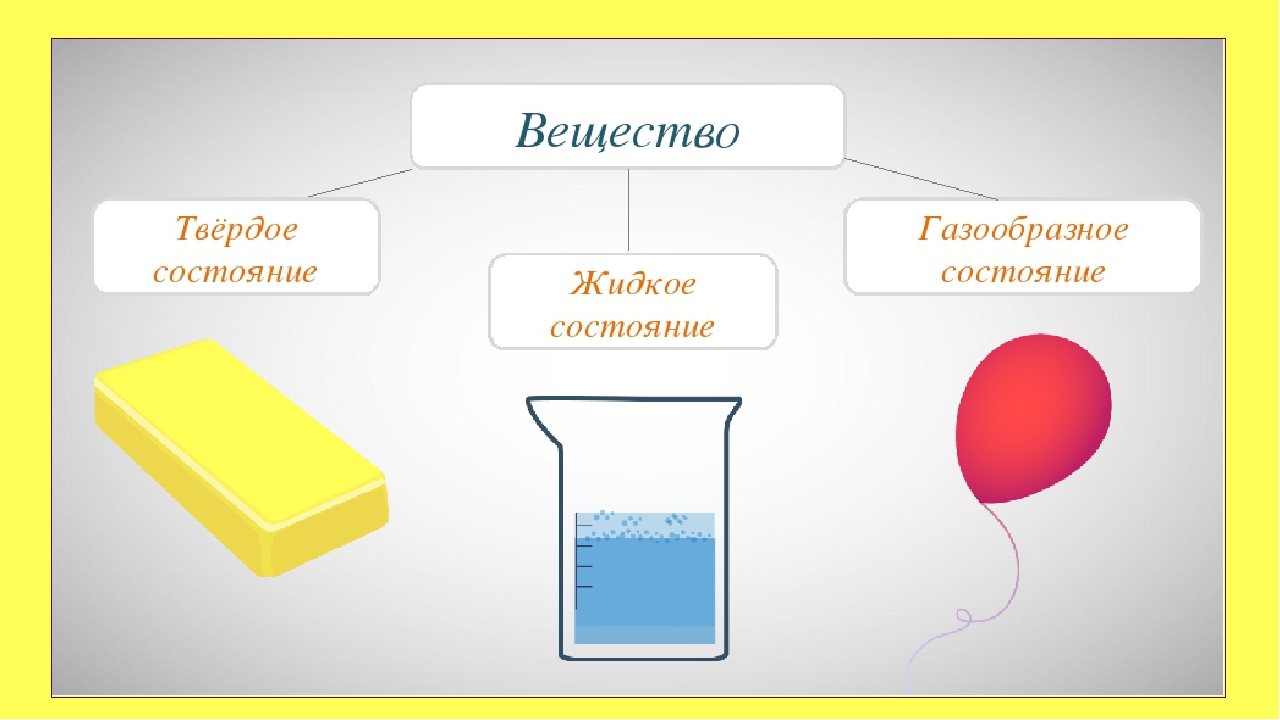
Что она собой представляет? Это частично или полностью И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы — это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород — О 2 , озон — О 3 , водород — Н 2 , хлор — CL 2 , фтор — F 2 , азот — N 2 и прочие.
- сероводород — H 2 S;
- хлороводород — HCL;
- метан — CH 4;
- сернистый газ — SO 2 ;
- бурый газ — NO 2 ;
- фреон — CF 2 CL 2 ;
- аммиак — NH 3 и прочие.
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей (метан, этан, пропан, бутан, пентан). Общая формула C n H 2n+2 ;
- этилен — С 2 Н 4 ;
- ацетилен или этин — С 2 Н 2 ;
- метиламин — CH 3 NH 2 и другие.

Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.

- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия — одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение — жидкость превращается в пар, сублимация — твердое вещество, минуя жидкое, становится газообразным.

Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.
Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких — сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов — процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
- в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*10 23 молекул для 1 моль любого газа.
- Ферми — создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт — фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.
Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии.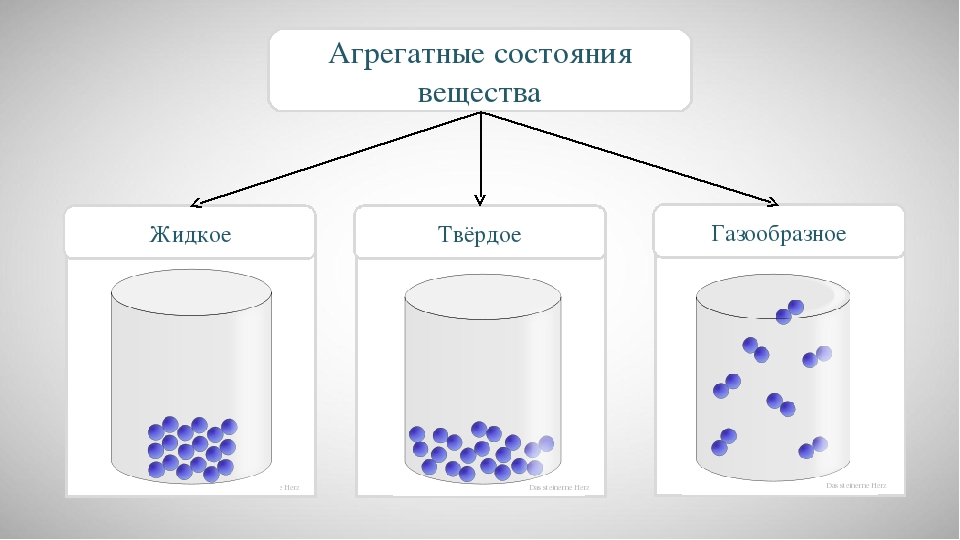
- фосфор белый — одна из данного элемента;
- азот;
- кислород;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон — О 3). Тип связи — ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях — темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа — I 2 .
К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.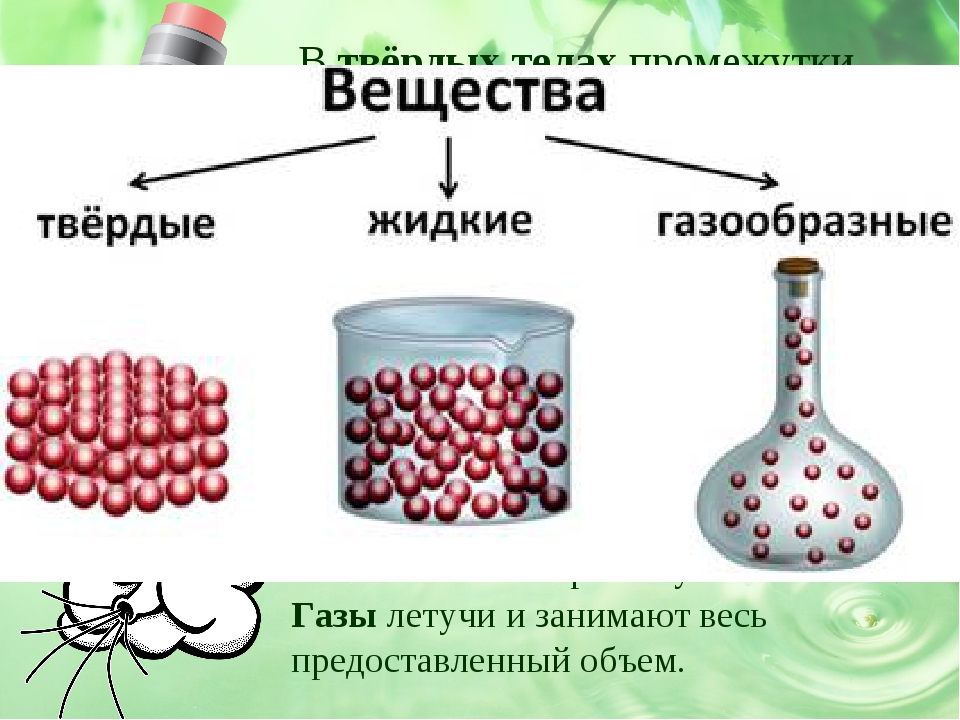
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений — важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием «газ» обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь — это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.
Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден — кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ — необходимый продукт «питания» для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ — важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы — это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи.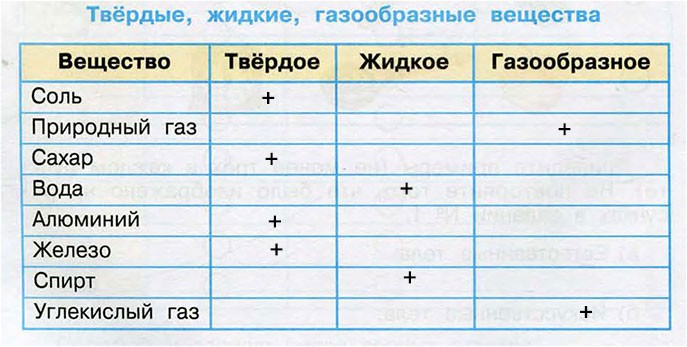 Однако не все галогены — газы. Бром — это жидкость при обычных условиях, а йод — легко возгоняющееся твердое вещество. Фтор и хлор — ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Однако не все галогены — газы. Бром — это жидкость при обычных условиях, а йод — легко возгоняющееся твердое вещество. Фтор и хлор — ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Газ (газообразное состояние) Газ – это агрегатное состояние вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью.
Особенности газов Легко сжимаются. Не имеют собственной формы и объема Любые газы смешиваются друг с другом в любых соотношениях.
Число Авогадро Значение NA = 6, 022…× 1023 называется числом Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Следствие из закона Авогадро 1 моль любого газа при н. у. (760 мм рт. ст. и 00 С) занимает объем 22, 4 л. Vm = 22. 4 л/моль – молярный объем газов
Важнейшие природные смеси газов Состав воздуха: φ(N 2) = 78%; φ(O 2) = 21%; φ(CO 2) = 0. 03 Природный газ – это смесь углеводородов.
03 Природный газ – это смесь углеводородов.
Получение водорода. В промышленности: Крекинг и риформинг углеводородов в процессе переработки нефти: C 2 H 6 (t = 10000 С) → 2 C + 3 H 2 Из природного газа. CH 4 + O 2 + 2 H 2 O → 2 CO 2 +6 H 2 O
Водород H 2 В лаборатории: Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту: Zn + 2 HCl → Zn. Cl 2 + H 2 Взаимодействие кальция с водой: Ca + 2 H 2 O → Ca(OH)2 + H 2 Гидролиз гидридов: Ca. H 2 + 2 H 2 O → Ca(OH)2 +2 H 2 Действие щелочей на цинк или алюминий: Zn + 2 Na. OH + 2 H 2 O Na 2 + H 2
Свойства водорода Самый лёгкий газ, он легче воздуха в 14, 5 раз. Водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха. Молекула водорода двухатомна — Н 2. При нормальных условиях — это газ без цвета, запаха и вкуса.
Кислород В промышленности: Из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. В лаборатории: Из перманганата калия (марганцовки): 2 KMn. O 4 = K 2 Mn. O 4 + Mn. O 2 + О 2 ; 2 H 2 O 2 = 2 Н 2 О + О 2.
Основным промышленным способом получения кислорода, является криогенная ректификация. В лаборатории: Из перманганата калия (марганцовки): 2 KMn. O 4 = K 2 Mn. O 4 + Mn. O 2 + О 2 ; 2 H 2 O 2 = 2 Н 2 О + О 2.
Свойства кислорода При нормальных условиях кислород — это газ без цвета, вкуса и запаха. 1 л его имеет массу 1, 429 г. Немного тяжелее воздуха. Слабо растворяется в воде и спирте Хорошо растворяется в расплавленном серебре. Является парамагнетиком.
Оксид углерода (IV) В лаборатории: Из мела, известняка или мрамора: Na 2 CO 3 + 2 HCl = 2 Na. Cl + CO 2 +H 2 O Сa. CO 3 + HCl = Ca. Cl 2 + CO 2 + H 2 O В природе: Фотосинтез в растениях: C 6 H 12 O 6 + 6 O 2 = 6 CO 2 + 6 H 2 O
Оксид углерода (IV) Оксид углерода (IV) (углекислый газ) – это бесцветный газ, без запаха, со слегка кисловатым вкусом. Тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда» . При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С.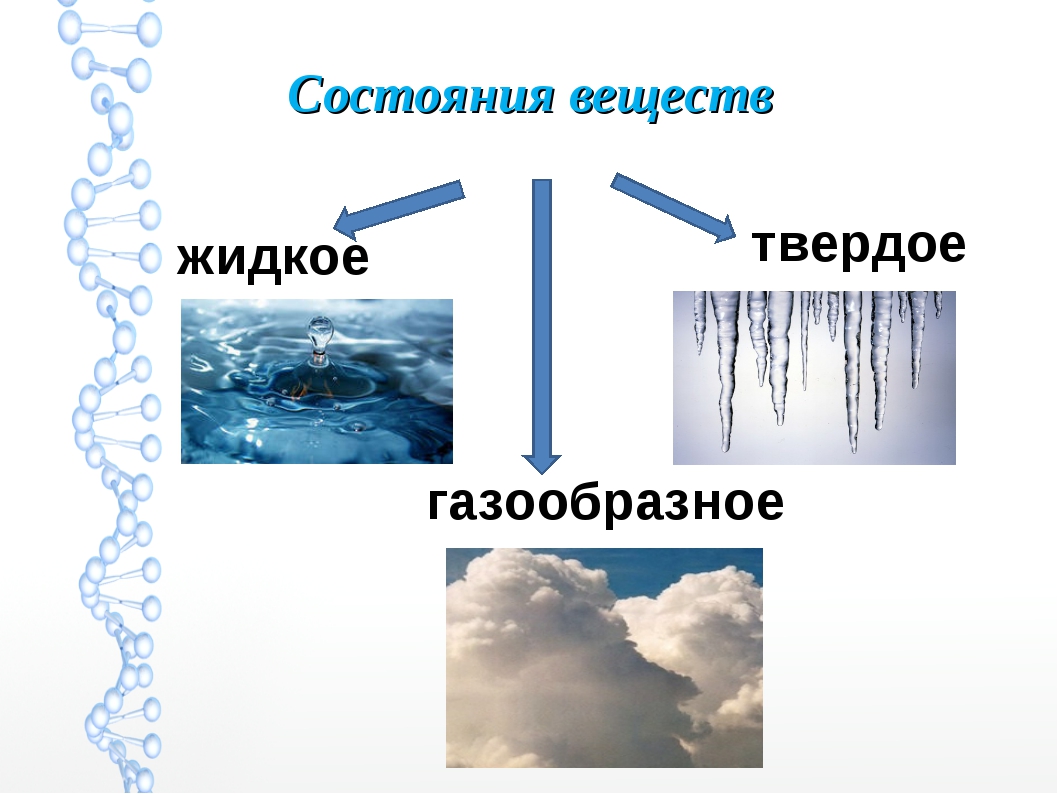
Аммиак (н. у.) – это бесцветный газ с резким характерным запахом (запах нашатырного спирта). Аммиак почти вдвое легче воздуха, растворимость NH 3 в воде чрезвычайно велика. В лаборатории аммиак получают: Взаимодействием щелочей с солями аммония: NH 4 Cl + Na. OH = Na. Cl + H 2 O + NH 3 В промышленности: Взаимодействие водорода и азота: 3 H + N = 2 NH
Этилен В лаборатории: Дегидратация этилового спирта В промышленности: Крекинг нефтепродуктов: C 4 H 10 → C 2 H 6 + C 2 H 4 этан этен
Этилен — бесцветный газ, обладающий слабым сладковатым запахом и относительно высокой плотностью. Этилен горит светящимся пламенем; с воздухом и кислородом образует взрывоопасную смесь. В воде этилен практически нерастворим.
Получение, собирание и распознавание газов Название газа (формула) Водород (H 2) Кислород (O 2) Углекислый газ (CO 2) Аммиак (NH 3) Этилен (С 2 H 4) Физические Лабораторный Способ свойства способ собирания получения Способ Значение распознаван газообразног ия о вещества
Задачи Задача № 1. 13, 5 грамм цинка (Zn) взаимодействуют с соляной кислотой (HCl). Объемная доля выхода водорода (H 2) составляет 85 %. Вычислить объем водорода, который выделился? Задача № 2. Имеется газовая смесь, массовые доли газа в которой равны (%): метана – 65, водорода – 35. Определите объемные доли газов в этой смеси.
13, 5 грамм цинка (Zn) взаимодействуют с соляной кислотой (HCl). Объемная доля выхода водорода (H 2) составляет 85 %. Вычислить объем водорода, который выделился? Задача № 2. Имеется газовая смесь, массовые доли газа в которой равны (%): метана – 65, водорода – 35. Определите объемные доли газов в этой смеси.
Задача № 1 1) Запишем уравнение реакции взаимодействия цинка (Zn) с соляной кислотой (HCl): Zn + 2 HCl = Zn. Cl 2 + H 2 2) n (Zn) = 13, 5 / 65 = 0, 2 (моль). 3) 1 моль Zn вытесняет 1 моль водорода (H 2), а 0, 2 моль Zn вытесняет х моль водорода (H 2). Получаем: V теор. (H 2) = 0, 2 ∙ 22, 4 = 4, 48 (л). 4) Вычислим объем водорода практический по формуле: V практ. (H 2) = 85 ⋅ 4, 48 / 100 = 3, 81 (л).
Задача № 2 Имеется газовая смесь, массовые доли газа в которой равны (%): метана – 65, водорода – 35. Определите объемные доли газов в этой смеси.
Лекция №12
Тема: «Средства, действующие на центральную нервную систему».
1. Средства для наркоза.
Средства для наркоза.
2. Этиловый спирт.
3. Снотворные средства
4. Противоэпилептические средства.
5. Противопаркинсонические средства
6. Анальгетики.
Средства, влияющие на ЦНС
Средства для наркоза.
Относятся вещества, вызывающие хирургический наркоз. Наркоз – обратимое угнетение функций ЦНС, которое сопровождается потерей сознания, утратой чувствительности, снижением рефлекторной возбудимости и мышечного тонуса.
Средства для наркоза угнетают передачу нервных импульсов в синапсах ЦНС. Синапсы ЦНС обладают неодинаковой чувствительностью к наркотическим веществам. Этим объясняется наличие стадий в действии средств для наркоза.
Стадии наркоза:
1. стадия анальгезии (оглушения)
2. стадия возбуждения
3. стадия хирургического наркоза
1-й уровень – поверхностный наркоз
2-й уровень легкий наркоз
3-й уровень глубокий наркоз
4-й уровень сверхглубокий наркоз
4. стадия пробуждения или агональная.
стадия пробуждения или агональная.
В зависимости от путей введения различают: ингаляционные и неингаляционные наркотические средства.
Ингаляционные наркотические вещества.
Вводят через дыхательные пути.
К ним относятся:
1. Летучие жидкости – эфир для наркоза, фторотан (галотан), хлорэтил, энфлуран, изофлуран, севофлуран.
2. газообразные вещества – закись азота, циклопропан, этилен.
Это легкоуправляемый наркоз.
Летучие жидкости.
Эфир для наркоза – бесцветная, прозрачная, летучая жидкость, взрывоопасная. Высокоактивная. Раздражает слизистую верхних дыхательных путей, угнетает дыхание.
Стадии наркоза.
1 стадия – оглушения (анальгезии). Угнетаются синапсы ретикулярной формации. Главный признак – спутанность сознания, снижение болевой чувствительности, нарушение условных рефлексов, безусловные сохранены, дыхание, пульс, АД почти не изменены. На этой стадии можно проводить кратковременные операции (вскрытие абсцесса, флегмоны и т.д.).
На этой стадии можно проводить кратковременные операции (вскрытие абсцесса, флегмоны и т.д.).
2 стадия – возбуждение. Угнетаются синапсы коры головного мозга. Включаются тормозные влияния коры на подкорковые центры, преобладают процессы возбуждения (растормаживается подкорка). «Бунт подкорки».Сознание утрачено, двигательное и речевое возбуждение (поют, ругаются), повышается мышечный тонус (больных привязывают).Усиливаются безусловные рефлексы – кашель, рвота. Дыхание и пульс учащены, АД повышено.
Осложнения: рефлекторная остановка дыхания, вторичная остановка дыхания: спазм голосовой щели, западение языка, аспирация рвотными массами. Эта стадия у эфира очень выражена. Оперировать на этой стадии нельзя.
3 стадия – хирургического наркоза. Угнетение синапсов спинного мозга. Угнетаются безусловные рефлексы, снижается мышечный тонус.
Операцию начинают на 2 уровне, а проводят на 3 уровне. Зрачки будут слегка расширены, почти не реагируют на свет, тонус скелетных мышц резко снижен, АД снижается, пульс чаще, дыхание меньше, редкое и глубокое.
При неправильной дозировке наркотического вещества может наступить передозирование. И тогда развивается 4 уровень сверхглубокий наркоз. Угнетаются синапсы центров продолговатого мозга – дыхательного и сосудодвигательного. Зрачки широкие на свет не реагирует, дыхание поверхностное, пульс частый, АД низкое.
При остановке дыхания сердце может еще работать некоторое время. Начинается реанимация, т.к. наблюдается резкое угнетение дыхания и кровообращения. Поэтому наркоз надо поддерживать на 3 стадии 3 уровня, не доводить до 4 уровня. В противном случае развивается агональная стадия. При правильной дозировке наркотических веществ и прекращения их введения развивается 4 стадия – пробуждения. Восстановление функций идет в обратном порядке.
При эфирном наркозе пробуждение наступает через 20-40 мин. Пробуждение сменяется длительным посленаркозным сном.
Во время наркоза у больного снижается температура тела, угнетается обмен веществ. Снижается выработка тепла. После эфирного наркоза могут возникнуть осложнения: пневмония, бронхит (эфир, раздражает дыхательные пути), перерождение паренхиматозных органов (печень, почки), рефлекторная остановка дыхания, сердечные аритмии, поражение проводящей системы сердца.
После эфирного наркоза могут возникнуть осложнения: пневмония, бронхит (эфир, раздражает дыхательные пути), перерождение паренхиматозных органов (печень, почки), рефлекторная остановка дыхания, сердечные аритмии, поражение проводящей системы сердца.
Фторотан – (галотан) – бесцветная, прозрачная, летучая жидкость. Негорючая. Сильнее эфира. Слизистые не раздражает. Стадия возбуждения короче, пробуждение быстрее, сон короче. Побочное действие – расширяет сосуды, снижает АД, вызывает брадикардию (для ее предупреждения вводят атропин).
Хлорэтил – сильнее эфира, вызывает легко управляемый наркоз. Быстро наступает и быстро проходит. Недостаток – малая широта наркотического действия. Оказывает токсическое действие на сердце и печень. Используют для рауш-наркоза (непродолжительный наркоз при вскрытии флегмон, абсцессов). Широко используют для местной анестезии, наносят на кожу. Кипит при температуре тела. Охлаждает ткани, снижает болевую чувствительность.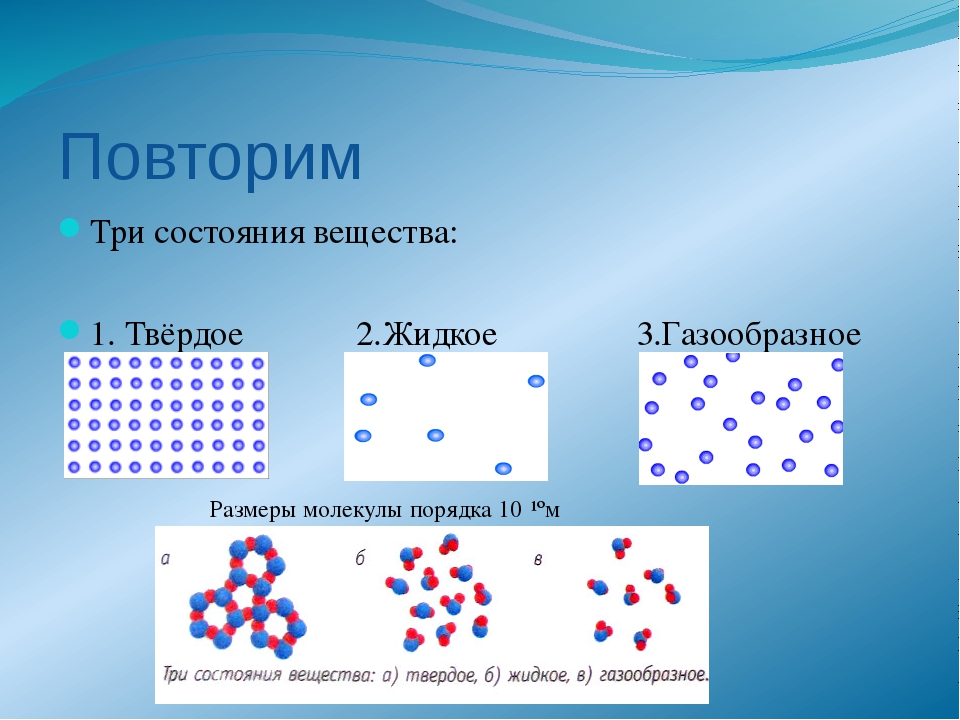 Применяют для поверхностного обезболивания при хирургических операциях, при миозитах, невралгии, растяжении связок, мышц. Нельзя переохлаждать ткани, т.к. может быть некроз.
Применяют для поверхностного обезболивания при хирургических операциях, при миозитах, невралгии, растяжении связок, мышц. Нельзя переохлаждать ткани, т.к. может быть некроз.
Газообразные вещества.
Закись азота – веселящий газ.
Выпускается в баллонах под давлением. Применяют в смеси с О 2 . Слабое наркотическое вещество. Комбинируют с другими наркотическими веществами – эфиром, веществами для внутривенного наркоза.
Наркоз наступает быстро, без стадии возбуждения. Быстро пробуждается. Наркоз поверхностный. Побочных эффектов нет. Применяют при травмах, инфаркте миокарда, транспортировке больных, хирургических вмешательствах.
Циклопропан – газ. В 6 раз сильнее закиси азота. Активен. Наркоз легко управляем.
Стадия возбуждение короткая, слабо выражена. Пробуждение сразу. Последствий почти нет. Осложнения – сердечные аритмии. Взрывоопасен.
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Назад
Вперёд
Назад
Вперёд
Возраст: 3 класс.
Тема: Тела, вещества, частицы.
Тип урока: изучение нового материала.
Продолжительность урока: 45 минут.
Цели урока: сформировать понятие тело, вещество, частица, научить различать вещества по их признакам и свойствам.
Задачи:
- Познакомить детей с понятиями тело, вещество, частица.
- Научить различать вещества в разных агрегатных состояниях.
- Развивать память, мышление.
- Совершенствовать навыки самооценки и самоконтроля.
- Повысить психологическую комфортность урока,
снятие мышечного напряжения (динамические паузы,
смена деятельности).

- Формировать дружеские отношения в коллективе.
- Воспитывать интерес к окружающему миру.
Оборудование:
1. Мультимедийная интерактивная презентация (Приложение 1) . Управление презентацией Приложение 2.
2. Рисунки (твёрдые, жидкие, газообразные вещества).
3. Металлическая линейка, резиновый мяч, деревянный кубик (у учителя).
4. Для эксперимента: стакан, чайная ложка, кусочек сахара; кипячёная вода (на столах у детей).
Ход урока
I. Организационный момент.
Учитель приветствует детей, проверяет готовность к уроку, обращаясь к учащимся: “Сегодня вы все задания будете выполнять в группах. Давайте повторим правила работы в группе” (слайд № 2).
- Обращение с товарищами – “вежливость”;
- Мнение других – “учись слушать, доказывать свою точку зрения”;
- Работа с источниками информации (со словарем, книгой) – выделяй главное.
II. Изучение нового материала.
Постановка учебной цели: сегодня мы начинаем
изучать тему “Эта удивительная природа” —
совершим виртуальную экскурсию (слайд № 3). На
слайде: капля воды, сахарница (контейнер для
хранения), молоток, волна (вода), глина, металл.
На
слайде: капля воды, сахарница (контейнер для
хранения), молоток, волна (вода), глина, металл.
Учитель задает вопрос “Все ли слова позволили точно представить предмет?”
Те слова, которые точно помогают представить предмет, а именно, имеют очертания, форму, называют телами. То, из чего сделаны эти предметы, называют веществами.
Работа с источником информации (словарь С.И. Ожегова):
Записать определение в тетради: “Те предметы, которые нас окружают, называются телами ” (слайд № 4).
Слайд № 5. Учитель предлагает учащимся сравнить картинки, расположенные на слайде: резиновый мяч, конверт, деревянный кубик.
Задание 1: найди общее. Все тела имеют размер, форму и т. д.
Задание 2: определи основные признаки тел. Ответ на слайде № 6: управляющая кнопка “ответ 2”.
Слайд № 6. Картинки – триггеры. Мяч – круглый, резиновый, яркий. Конверт – прямоугольный, бумажный, белый. Кубик – деревянный, большой, бежевый.
Вместе с ребятами делаем вывод “Каждое тело
имеет размер, форму, цвет”. Записываем в тетрадь.
Записываем в тетрадь.
Слайд № 7. Что такое природа? Из трех вариантов ответов выбрать правильный ответ:
Слайд № 8 – работа с карточками. У учащихся на столах карточки с изображением тел (предметов). Предложим учащимся разделить карточки на две группы: стол, солнце, дерево, карандаш, облако, камень, книги, кресло. Запишем в тетради ответы. Просим учащихся прочитать названия тел, это будет 1 группа. По какому признаку они поместили слова в эту группу? Тоже делаем со второй группой.
Правильный ответ:
Делаем вывод. Как мы разделили слова (по какому принципу?): есть тела, которые созданы природой, а есть те, которые созданы руками человека.
Оформляем блок в тетрадь (Рисунок 1).
Слайд № 9. Прием “Интерактивная лента”. На
слайде представлены тела естественные и
искусственные. С помощью кнопки – прокрутки,
которая одновременно является триггером,
просматриваем тела естественные и искусственные
(каждый раз нажатие на кнопку осуществляет смену
сгруппированных картинок).
Закрепляем полученные знания с помощью игры “Светофор” (слайды 10-12). Игра заключается в поиске правильного ответа.
Слайд 10. Задание: найди естественные тела. Из предложенных тел на слайде необходимо выбрать только естественные тела. Картинка является триггером – при нажатии появляется сигнал светофора (красный или зеленый). Звуковые файлы помогают учащимся убедиться в выборе правильного ответа.
Учитель.Вспомним то, о чем мы говорили вначале.Мы затруднялисьточно определить, являются лиметалл, вода, глина телами и пришли к выводу, что они не имеют точных очертаний, формы, а значит, не являются телами. Данные слова мы называем веществами. Все тела состоят из веществ. Записываем в тетрадь определение.
Слайд 13. На данном слайде рассмотрим два примера.
Пример 1: ножницы – тело, то, из чего они сделаны – вещество (железо).
Пример 2: капли воды – тела, вещество, из которого состоят капли – вода.
Слайд № 14. Рассмотрим тела, которые состоят из
нескольких веществ. Например, карандаш и лупа. На
слайде отдельно смотрим вещества, из которых
состоит карандаш. Для демонстрации нажимаем на
управляющие кнопки: “графит”, “каучук”,
“дерево”. Для того чтобы убрать ненужную
информацию нажимаем крестик .
Например, карандаш и лупа. На
слайде отдельно смотрим вещества, из которых
состоит карандаш. Для демонстрации нажимаем на
управляющие кнопки: “графит”, “каучук”,
“дерево”. Для того чтобы убрать ненужную
информацию нажимаем крестик .
Рассмотрим, из каких веществ состоит лупа. Нажимаем триггеры “стекло”, “дерево”, “металл”.
Слайд № 15. Для закрепления рассмотрим еще два примера. Из чего состоит молоток? Молоток состоит из железа и дерева (рукоятка). Из чего состоят ножи? Ножи состоят из веществ железа и дерева.
Слайд № 16. Рассмотрим два предмета, которые состоят из нескольких веществ. Мясорубка: из железа и дерева. Санки: из железа и дерева.
Слайд 17. Делаем вывод: тела могут состоять из одного вещества, а могут из нескольких.
Слайды 18, 19, 20. Прием “Интерактивная лента”. Демонстрируем учащимся. Одно вещество может входить в состав нескольких тел.
Слайд 18. Вещества полностью или частично состоят из стекла.
Слайд 19. Вещества полностью или частично
состоят их металла.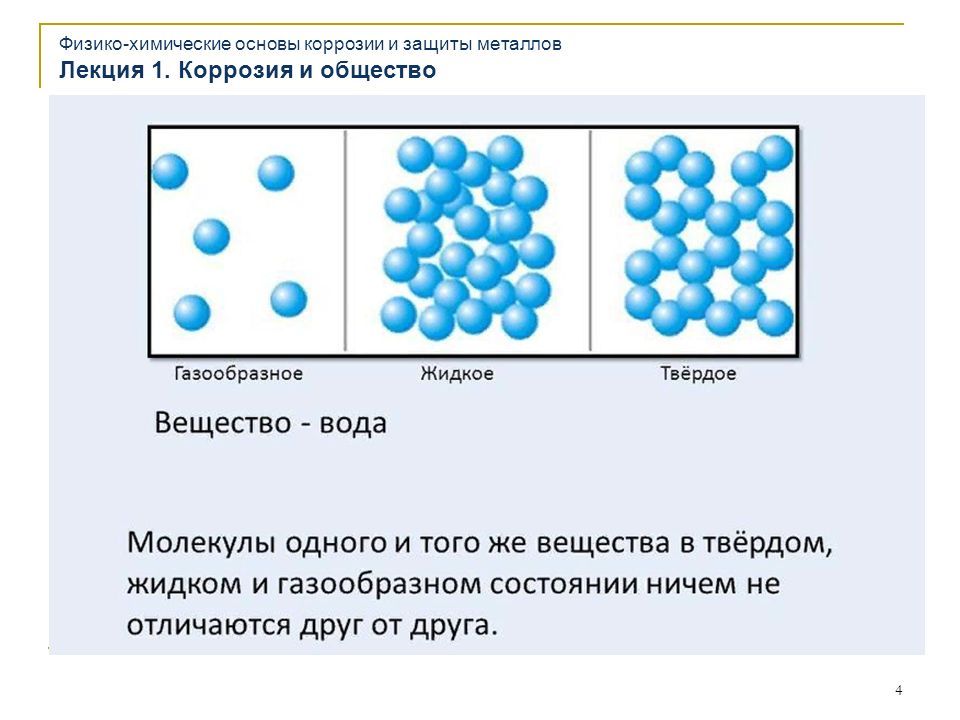
Слайд 20. Вещества полностью или частично состоят из пластмассы.
Слайд 21. Учитель задает вопрос “А все ли вещества одинаковы?”
На слайде нажимаем управляющую кнопку “Начать”. Запись в тетради: все вещества состоят из мельчайших невидимых частиц. Вводим классификацию веществ по агрегатному состоянию: жидкие, твердые, газообразные. На слайде используются триггеры (стрелочки). При нажатии на стрелочку можно посмотреть картинку с частицами в данном агрегатном состоянии. Повторное нажатие на стрелочку – объекты исчезнут.
Слайд 22. Экспериментальная часть. Необходимо доказать, что частицы – мельчайшие, невидимые глазом, но сохраняющие свойства вещества.
Проделаем эксперимент. На столах у учащихся лотки с набором простейшего лабораторного оборудования: стаканчик, ложечка для размешивания, салфетка, кусочек сахара.
Опустить кусочек сахара в стакан, перемешать до
полного растворения. Что наблюдаем? Раствор стал
однородным, мы больше не видим кусочка сахара в
стакане воды.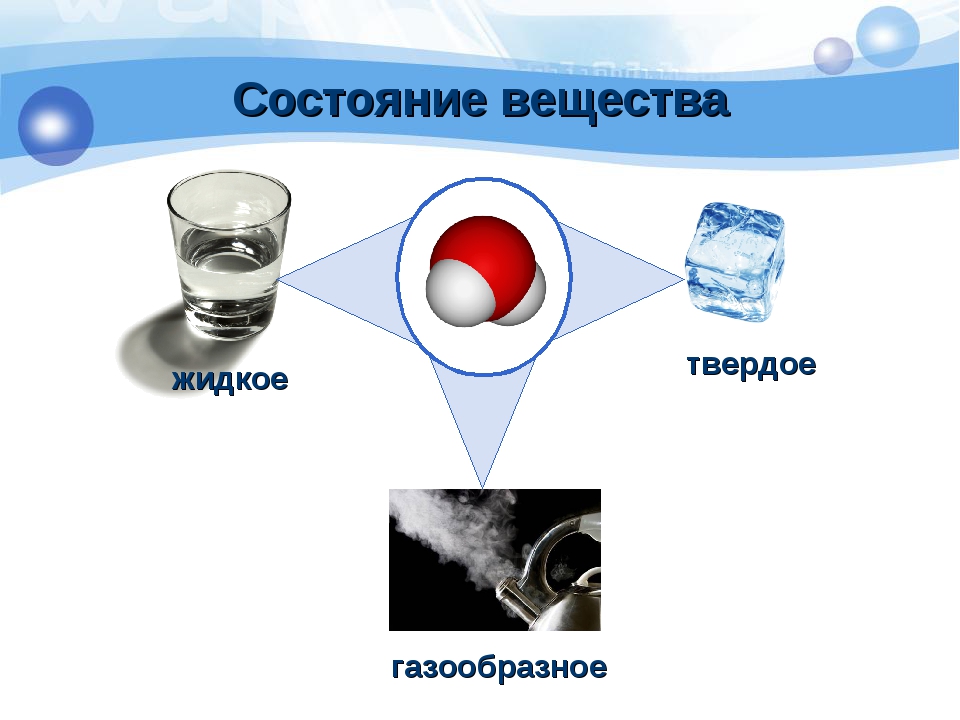 Доказать, что в стакане по-прежнему
присутствует сахар. Каким образом? Попробовать
на вкус. Сахар: вещество белого цвета, сладкое на
вкус. Вывод: после растворения сахар не перестал
быть сахаром, потому что остался сладким. Значит,
сахар состоит из мельчайших частиц, не видимых
глазу (молекул).
Доказать, что в стакане по-прежнему
присутствует сахар. Каким образом? Попробовать
на вкус. Сахар: вещество белого цвета, сладкое на
вкус. Вывод: после растворения сахар не перестал
быть сахаром, потому что остался сладким. Значит,
сахар состоит из мельчайших частиц, не видимых
глазу (молекул).
Слайд 23. Рассмотрим расположение частиц в веществах с твердым агрегатным состоянием. Демонстрируем расположение частиц и вещества (примеры) с помощью приема “интерактивная лента” — кнопка прокрутки позволяет показать картинки нужное число раз. Записываем вывод в тетради: в твердых веществах частицы располагаются близко к друг другу.
Слайд 24. Расположение частиц в жидких веществах. В жидких веществах частицы расположены на некотором расстоянии друг от друга.
Слайд № 25. Расположение частиц в газообразных веществах: частицы расположены далеко друг от друга, расстояние между ними значительно превышает сам размер частиц.
Слайд 31. Настало время подвести итоги. Вместе с
учителем вспоминают то, что нового узнали на
уроке. Учитель задает вопросы:
Учитель задает вопросы:
- Все, что нас окружает, называется….телами
- Тела бывают естественные и искусственные .
- Записать в тетради схему. Учитель: рассмотрим схему. Тела бывают естественные и искусственные, вещества могут быть твердые, жидкие, газообразные. Вещества состоят из частиц. Частица сохраняет свойства вещества (вспомним, что сахар при растворении остался сладким). На слайде используются триггеры. Нажимаем на фигуру “Тела”, появляются стрелочки, затем фигуры с надписью “Искусственные” и “Естественные”. При нажатии на фигуру “вещества” появляются три стрелочки (жидкие, твердые, газообразные).
Слайд № 30. Заполните таблицу. Внимательно читайте инструкцию.
(Отметьте знаком “+ ” в соответствующей графе, какие из перечисленных веществ относятся к твёрдым, жидким, газообразным).
| Вещество | Твёрдое | Жидкое | Газообразное |
| Соль | |||
| Природный газ | |||
| Сахар | |||
| Вода | |||
| Алюминий | |||
| Спирт | |||
| Железо | |||
| Углекислый газ |
Проверка выполнения работы (слайд 30). По очереди
дети называют вещество и объясняют, к какой
группе его отнесли.
По очереди
дети называют вещество и объясняют, к какой
группе его отнесли.
Итог урока
1) Подведение итогов
Вы дружно работали.
Узнаем, какая группа была самой внимательной на уроке. Учитель задает вопрос: “Что называется телами, что характеризует тело, приведи пример”. Учащиеся отвечают. Все, что нас окружает, называется телами. Какие бывают вещества по агрегатному состоянию: жидкие, твердые, газообразные. Из чего состоят вещества? Приведите примеры, как частицы сохраняют свойства веществ. Например, если мы посолили суп, как узнать, что свойства вещества сохранились? Попробовать на вкус. Заполните схему (Рисунок 2)
Обсуждение: с чем согласны, с чем не согласны.
Что нового узнали? Дети сообщают. (Телами называют все предметы, окружающие нас. Тела состоят из веществ. Вещества — из частиц).
Домашнее задание
Учитель сообщает детям домашнее задание (на выбор):
- решить небольшой тест (Приложение 5).
- интерактивный тест (Приложение 3).

- просмотреть презентацию о воде (Приложение 7) . В презентации можно познакомиться с шестью известными фактами про воду. Подумайте, ребята, а почему именно с этим веществом нужно познакомиться поближе? Ответ: самое распространенное вещество на Земле. А какое еще вещество вы хотели бы пригласить к себе (создание виртуальных экскурсий).
- изучить электронный учебник (Приложение 4).
Примечание: учитель может использовать дополнительно слайды № 32, 33, 36.
Слайд № 32. Задание: проверь себя. Найди изделия (интерактивный тест).
Слайд № 33. Задание: проверь себя. Найди тела живой и неживой природы (интерактивный тест).
Слайд № 36. Задание: раздели тела на тела живой и неживой природы (интерактивный тест).
Литература.
- Грибов П.Д. как человек исследует, изучает, использует природу. 2-3 классы. Волгоград: Учитель, 2004.-64 с.
- Максимова Т.Н. Поурочные разработки по курсу
“Окружающий мир”: 2 класс.
 — М.: ВАКО, 2012.-336с. — (В
помощь школьному учителю).
— М.: ВАКО, 2012.-336с. — (В
помощь школьному учителю). - Решетникова Г.Н., Стрельников Н.И. Окружающий мир. 3 класс: занимательные материалы.- Волгоград: Учитель, 2008. – 264 с.: ил.
- Тихомирова Е.М. Тесты по предмету “Окружающий мир”: 2 класс: к учебному комплекту А.А. Плешакова “Мир вокруг нас. 2 класс”. — М.: Издательство “Экзамен”, 2011. — 22 с.
Вода и газ. Все они различаются по своим свойствам. Особое место в этом списке занимают жидкости. В отличие от твердых тел, в жидкостях молекулы не расположены упорядочено. Жидкость — это особое состояние вещества, являющееся промежуточным между газом и твердым телом. Вещества в этом виде могут существовать только при строгом соблюдении интервалов определенных температур. Ниже этого интервала жидкое тело превратится в твердое, а выше — в газообразное. При этом границы интервала напрямую зависят от давления.
Вода
Одним из основных примеров жидкого тела является вода. Несмотря на принадлежность к данной категории, вода может принимать форму твердого тела или газа — в зависимости от температуры окружающей среды. В процессе перехода из состояния жидкости в твердое, молекулы обычного вещества сжимаются. Но вода ведет себя совершенно иначе. При замерзании ее плотность снижается, и вместо того, чтобы тонуть, лед выплывает на поверхность. Вода в своем обычном, текучем, состоянии обладает всеми свойствами жидкости — у нее всегда имеется конкретный объем, однако, нет определенной формы.
В процессе перехода из состояния жидкости в твердое, молекулы обычного вещества сжимаются. Но вода ведет себя совершенно иначе. При замерзании ее плотность снижается, и вместо того, чтобы тонуть, лед выплывает на поверхность. Вода в своем обычном, текучем, состоянии обладает всеми свойствами жидкости — у нее всегда имеется конкретный объем, однако, нет определенной формы.
Поэтому вода всегда сохраняет тепло под поверхностью льда. Даже если температура окружающей среды составляет -50°С, то подо льдом она все равно будет составлять около нуля. Однако в начальной школе можно не углубляться в подробности свойств воды или других веществ. В 3 классе примеры жидких тел можно приводить самые простые — и в этот список желательно включить воду. Ведь ученик начальной школы должен иметь общие представления о свойствах окружающего мира. На данном этапе достаточно знать, что вода в ее обычном состоянии является жидкостью.
Натяжение поверхности — свойство воды
Вода обладает большим, чем другие жидкости, показателем натяжения поверхности. Благодаря этому свойству образуются капли дождя, а, следовательно, и поддерживается круговорот воды в природе. Иначе пары воды не могли бы так легко превратиться в капли и пролиться на поверхность земли в виде дождя. Вода, действительно, является примером жидкого тела, от которого напрямую зависит возможность существования живых организмов на нашей планете.
Благодаря этому свойству образуются капли дождя, а, следовательно, и поддерживается круговорот воды в природе. Иначе пары воды не могли бы так легко превратиться в капли и пролиться на поверхность земли в виде дождя. Вода, действительно, является примером жидкого тела, от которого напрямую зависит возможность существования живых организмов на нашей планете.
Поверхностное натяжение объясняется тем, что молекулы жидкости притягиваются друг к другу. Каждая из частиц стремится окружить себя другими и уйти с поверхности жидкого тела. Именно поэтому мыльные и образующиеся при кипении воды пузыри стремятся принять жидкую форму — при этом объеме минимальной толщиной поверхности может обладать только шар.
Жидкие металлы
Однако не только привычные для человека вещества, с которым он имеет дело в повседневности, принадлежат к классу жидких тел. Среди этой категории немало различных элементов периодической системы Менделеева. Примером жидкого тела также является ртуть. Это вещество широко применяется в изготовлении электротехнических приборов, металлургии, химической промышленности.
Ртуть является жидким, блестящим металлом, испаряющимся уже при комнатной температуре. Она способна растворять серебро, золото и цинк, образуя при этом амальгамы. Ртуть является примером того, какие бывают жидкие тела, относящиеся к категории опасных для жизни человека. Ее пары токсичны, опасны для здоровья. Поражающее действие ртути проявляется, как правило, через некоторое время после контакта отравления.
Металл под названием цезий также относится к жидкостям. Уже при комнатной температуре он находится в полужидкой форме. Цезий на вид представляет собой вещество золотисто-белого оттенка. Данный металл немного похож на золото по цвету, однако, светлее его.
Серная кислота
Примером того, какие бывают жидкие тела, также являются и практически все неорганические кислоты. К примеру, серная кислота, на вид представляющая собой тяжелую маслянистую жидкость. У нее нет ни цвета, ни запаха. При нагревании она становится очень сильным окислителем. На холоде она не вступает во взаимодействие с металлами — например, железом и алюминием. Данное вещество проявляет свои характеристики только в чистом виде. Разбавленная серная кислота не проявляет окислительных свойств.
Данное вещество проявляет свои характеристики только в чистом виде. Разбавленная серная кислота не проявляет окислительных свойств.
Свойства
Какие жидкие тела существуют помимо перечисленных? Это кровь, нефть, молоко, минеральное масло, алкоголь. Их свойства позволяют этим веществам легко принимать форму тары. Как и другие жидкости, эти вещества не теряют своего объема, если перелить их из одного сосуда в другой. Какие же еще свойства присущи каждому из веществ в данном состоянии? Жидкие тела и их свойства хорошо изучены физиками. Рассмотрим их основные характеристики.
Текучесть
Одна из главнейших характеристик любого тела данной категории — это текучесть. Под данным термином понимается способность тела принимать различную форму, даже если не него оказывается относительно слабое воздействие извне. Именно благодаря данному свойству каждая жидкость может разливаться струями, разбрызгиваться по окружающей поверхности каплями. Если бы тела данной категории не обладали текучестью, было бы невозможным налить воду из бутылки в стакан.
При этом данное свойство выражается у разных веществ в различной степени. Например, мед меняет форму очень медленно по сравнению с водой. Данную характеристику называют вязкостью. Это свойство зависит от внутреннего строения жидкого тела. Например, молекулы меда больше похожи на ветви дерева, а молекулы воды, скорее, напоминают шарики с небольшими выпуклостями. При движении жидкости частицы меда будто «цепляются друг за друга» — именно этот процесс и придает ему большую вязкость, нежели другим типам жидкостей.
Сохранение формы
Нужно помнить и о том, что о каком бы примере жидких тел ни шла речь, они меняют только форму, но не меняют объем. Если налить воды в мензурку, и перелить ее в другую емкость, данная характеристика не изменится, хотя и само тело примет форму нового сосуда, в который его только что перелили. Свойство сохранения объема объясняется тем, что между молекулами действуют как силы взаимного притяжения, так и отталкивающие. Нужно отметить, что жидкости практически невозможно сжать посредством внешнего воздействия за счет того, что они всегда принимают форму контейнера.
Жидкие и твердые тела отличаются тем, что последние не подчиняются Напомним, что данное правило описывает поведение всех жидкостей и газов, и заключается в их свойстве передавать оказываемое на них давление во все стороны. Однако нужно отметить, что те жидкости, которые обладают меньшей вязкостью, делают это быстрее, чем более вязкие жидкие тела. Например, если оказать давление на воду или спирт, то оно распространится достаточно быстро.
В отличие от этих веществ, давление на мед или жидкое масло будет распространяться медленнее, однако, так же равномерно. В 3 классе примеры жидких тел можно приводить без указания их свойств. Более детальные знания школьникам понадобятся в старших классах. Однако если ученик подготовит дополнительный материал, это может поспособствовать получению более высокой оценки на уроке.
Урок окружающего мира: «Твердые, жидкие и газообразные тела»
Твердые тела, жидкости и газы 1 класс
Цель: Познакомить детей с важнейшей характеристикой физических тел – агрегатным состоянием.
Задачи:
Обучающие: учить выделять признаки окружающих предметов и обнаруживать их взаимосвязи.
Развивающие: развивать творческие способности учащихся; умение ориентироваться в полученных знаниях, использовать их в жизни.
Воспитательные: воспитывать интерес к предмету, бережное отношение к окружающим предметам.
Оборудование:
Демонстрационное: компьютер, проектор, экран, 4 стакана, вода, брусок, таз с водой, салфетка, духи
Раздаточное: 3 стакана на каждую парту, вода, деревянные бруски, целлофановые пакеты
ЦОР
Ход урока
На столе учащихся и учителя материалы для опытов (3 стакана, один из которых с водой, другой пустой, 3-с деревянным бруском, пакеты целлофановые).
- Орг. Момент
Приветствие гостей.
— Ребята, сегодня к нам на урок пришли гости, давайте поприветствуем их. Теперь посмотрите друг на друга, улыбнитесь. Вижу, вы к уроку готовы. Тихо садитесь.
Сегодня мы с вами отправимся в нашу маленькую лабораторию (слайд), которую создали сами в нашем классе. А что такое лаборатория? И мы будем лаборантами. Но чтобы начать проводить различные опыты, давайте вспомним правила поведения в лаборатории.(слайд) Каждый из лаборантов их должен выполнять:
- Внимательно слушать старшего лаборанта;
- Не шуметь, не мешать друг другу;
- Выполнять все задания.
— Эти правила у нас вынесены и на доску, чтобы вы могли при необходимости их вспомнить.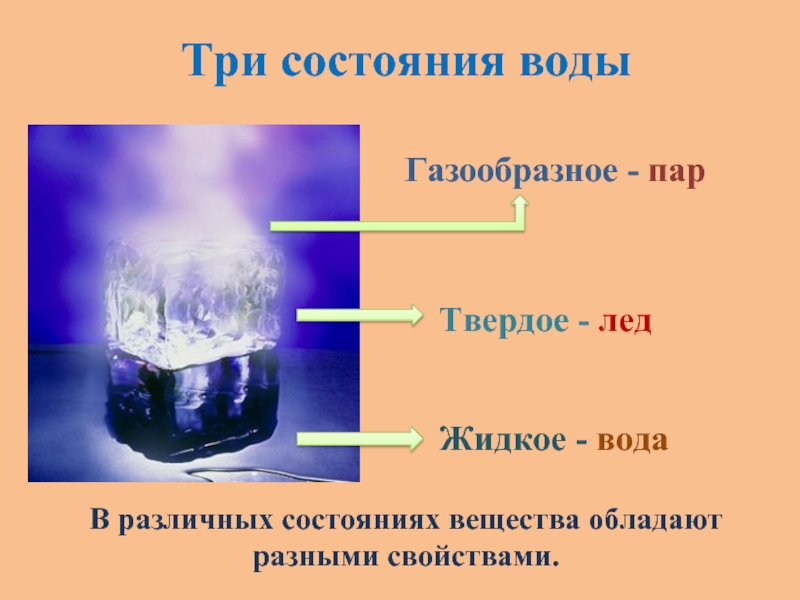
— Готовы начать работу?
- Актуализация знаний и постановка проблемы.
У вас на столах по три стакана. Что в первом стакане? (вода).
Что во 2 стакане? (деревянный брусок).
Что в третьем стакане? (ответы детей)
Возьмите пакеты и зажмите их рукой у горлышка. Что вы видите? (пакет надулся). Что в пакете? (выполняю задание вместе с детьми)
Загадка:
Через нос проходит в грудь
И обратный держит путь.
Он невидимый, и все же
Без него мы жить не можем. (воздух)
— А что в стакане? Как проверить? (опыт проделывает подготовленный ребенок: подходит к столу учителя, где стоит тазик с водой. Как вы думаете, намокнет ли салфетка, прикрепленная ко дну стакана, если стакан опустить в воду к верху дном? Опускает. Почему салфетка осталась сухой? (воздух не дал намочить салфетку)
Как вы думаете, намокнет ли салфетка, прикрепленная ко дну стакана, если стакан опустить в воду к верху дном? Опускает. Почему салфетка осталась сухой? (воздух не дал намочить салфетку)
— А для чего нам нужен воздух?
— Нас окружают различные предметы, по другому их называют физические тела. Можно ли воздух назвать телом? Какие еще бывают тела?
Как вы думаете, они все одинаковые? Чем они отличаются?
Дети перечисляют признаки предметов (размер, форму, цвет, материал).
— Чем отличаются предметы в ваших стаканчиках?
Приходят к выводу, что вода жидкая, брусок – твердый, воздух – при помощи учителя, это газ.
Оказывается, все предметы можно еще разделить на три большие группы:
На слайде и доске надписи:
Твердые тела Жидкости Газы
— Учитель обращает внимание на слова на доске.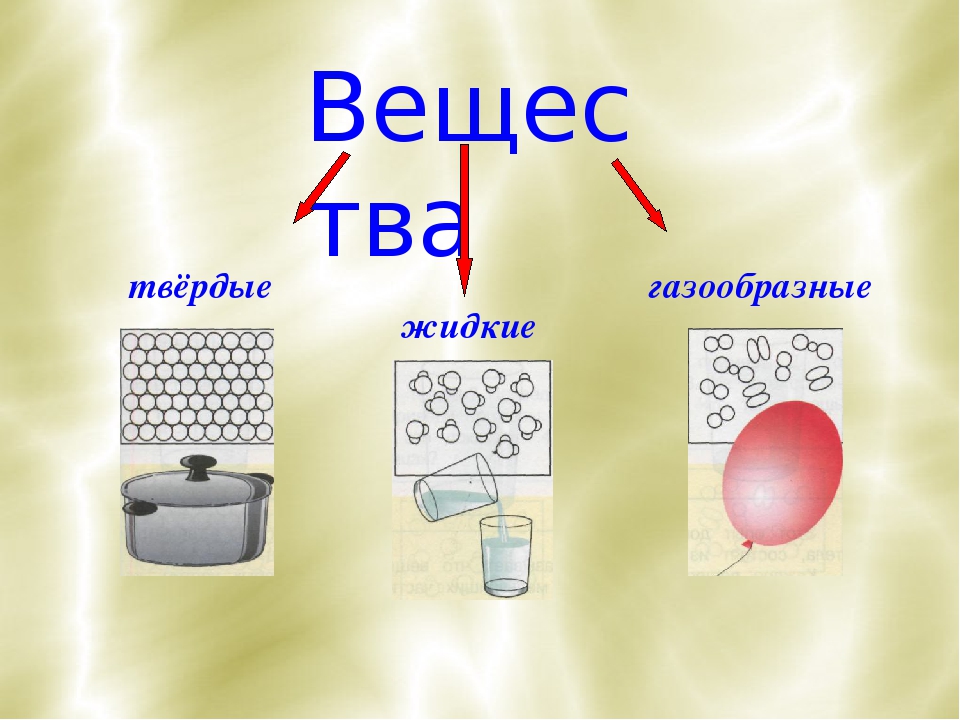 Заполняется таблица.
Заполняется таблица.
|
Твердые тела |
Жидкости |
Газы |
|
Брусок |
Вода |
Воздух |
|
Пенал |
Чай |
Природный газ |
|
Лёд |
Молоко |
Пар |
— Давайте попробуем определить к какой группе относятся следующие тела.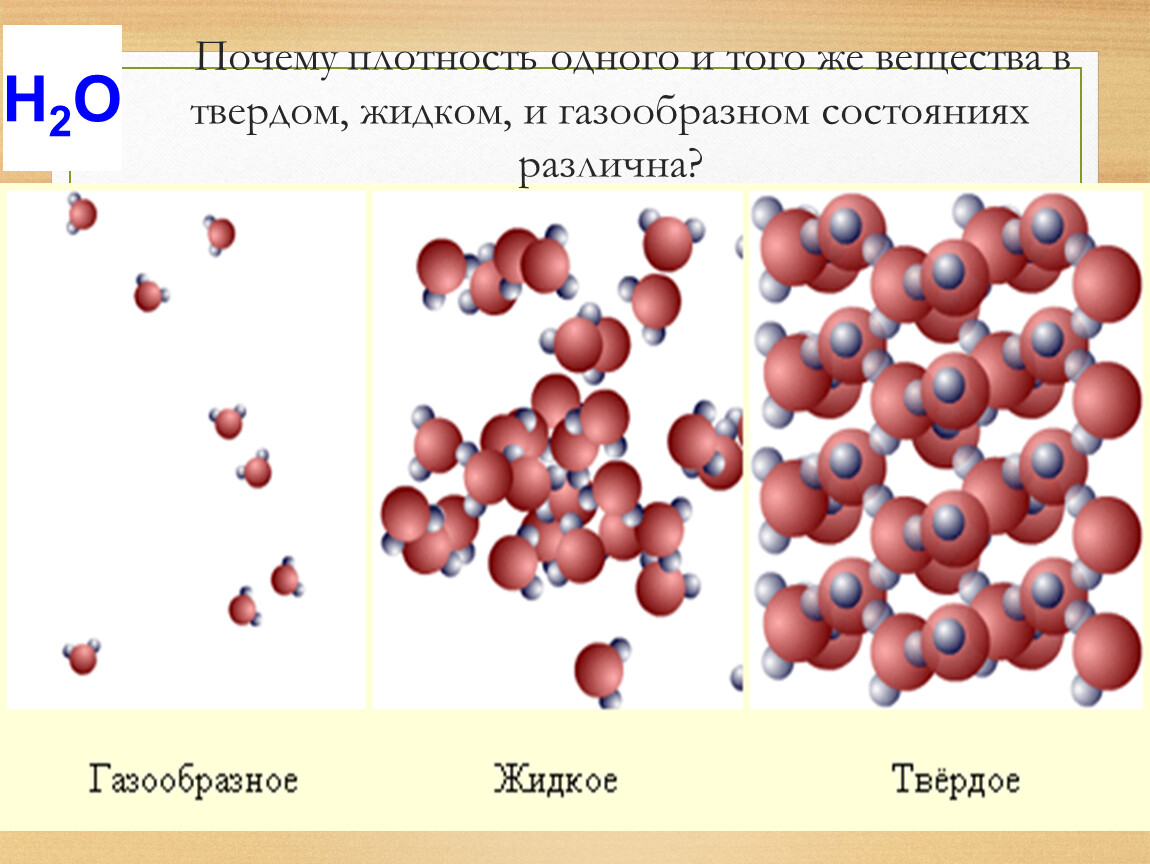 На доске вы видите названия этих тел. Попробуйте догадаться, вода какое тело? Брусок?…(по ходу объяснения вызываю по одному ребенку, который ставит слово в нужный столбик)
На доске вы видите названия этих тел. Попробуйте догадаться, вода какое тело? Брусок?…(по ходу объяснения вызываю по одному ребенку, который ставит слово в нужный столбик)
— Как вы думаете, о чем мы будем говорить на уроке?
— Действительно, сегодня мы с вами познакомимся с неживыми физическими телами, которые отличаются своими состояниями, бывают твердыми, жидкими и газообразными. Ну и, конечно, проделаем ряд опытов, которые покажут нам, чем же особенны эти состояния веществ.
— Давайте попробуем вместе выяснить, чем же отличаются тела, которые находятся в различных состояниях: твердом, жидком и газообразном.
- Исследовательская работа
1 свойство (опыт): Пробуем сжать брусок – не сжимается. Учитель при помощи шприца пробует сжать воду – не сжимается, а газ сжимается.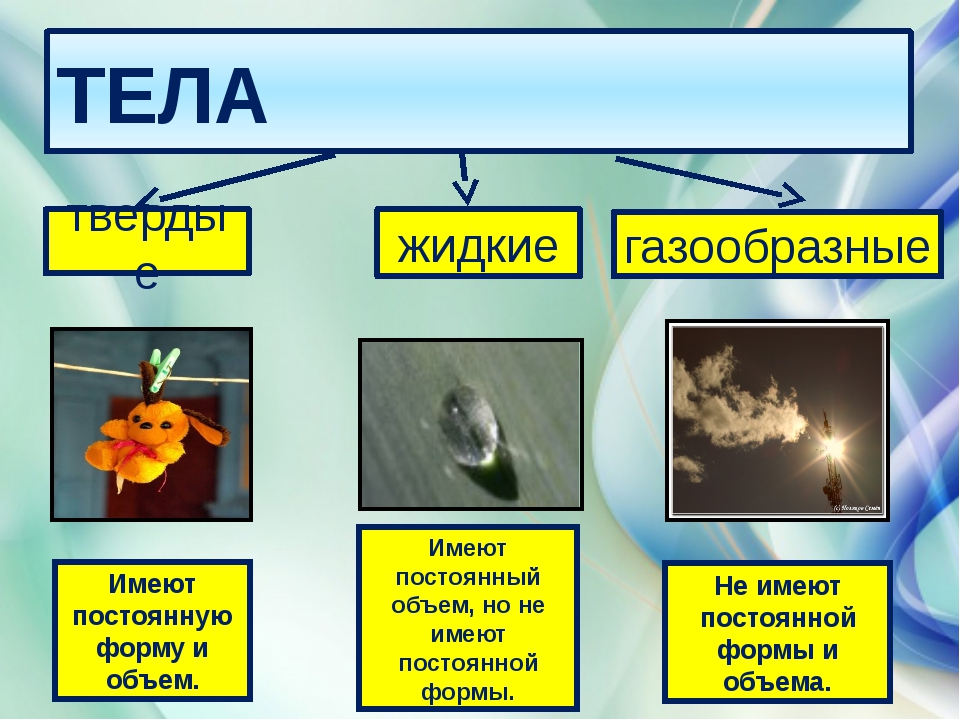 Дает попробовать детям.
Дает попробовать детям.
Вывод: Твердые тела и жидкости не сжимаются, а газ – сжимается.
2 свойство (опыт): Разделить все вещества и материалы на 2 группы: сохраняющие форму и не сохраняющие форму.
— Учитель переливает воду из одного сосуда в другой.
— Какую форму приобретает жидкость при переливании из одного сосуда в другой? (жидкость сохраняет форму сосуда)
— Переложите брусок из одного стакана в другой. Изменил ли он форму? (нет, это твердое тело)
Вывод выносится на слайд: Твердые тела сохраняют свою форму, а жидкости сохраняют форму сосуда.
3 свойство:
— Мы говорили о твердых телах, жидкостях. А еще о каких телах нам нужно поговорить? (о газах)
— Сейчас вы ляжете все на парту и закроете глаза, когда я вам предложу проснуться, вы сможете поднять головы.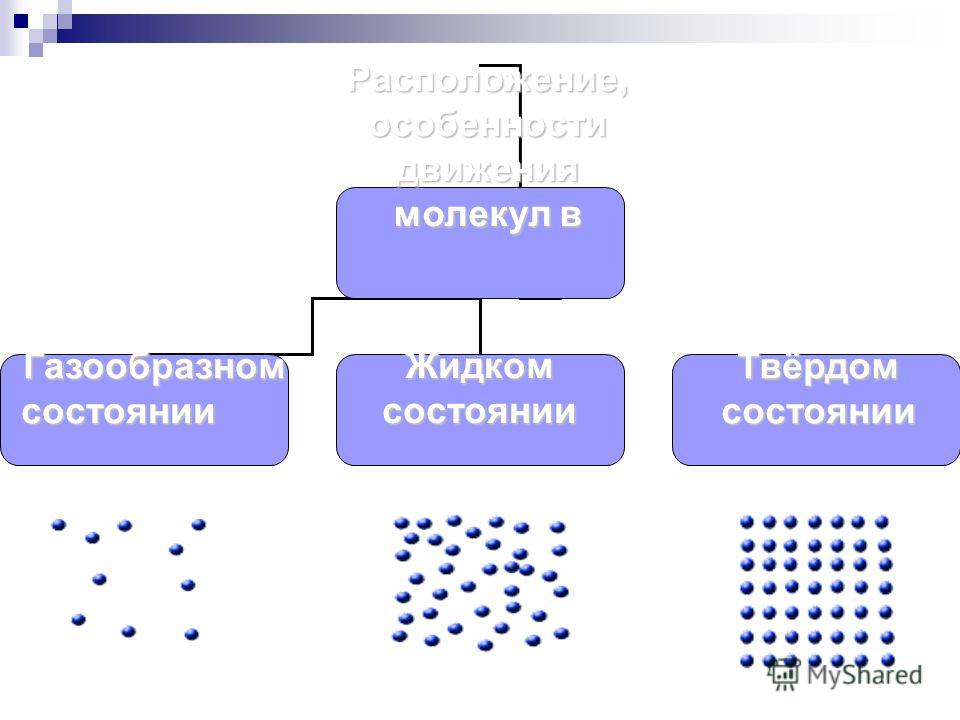
Пока дети лежат, я разбрызгиваю духи.
— Просыпайтесь, поднимайте головы. Вы ничего не чувствуете? Все почувствовали? А на задних партах?
— Почему, ведь я разбрызгивала у доски?
Вывод: Оказывается, газы занимают все помещение, где они находятся.
Физкультминутка
На слайдах появляется интерактивная модель, изображающий молекулярное строение тел: твердых, жидких и газообразных.
— Ребята, почему же все так происходит? Почему твердые тела не могут течь, жидкие не могут сохранять определенную форму, а газы занимают весь объем помещения?
— Оказывается, все тела состоят из очень маленьких частиц, которые называются молекулы. Но в каждом теле молекулы располагаются по-разному. (слайд) Например, в твердом теле каждая молекула движется около определенной точки. В жидкостях молекулы не так крепко соединены и дают возможность перемещаться из одного положения в другое. А в газах, молекулы и вовсе не соединены друг с другом, поэтому легко разлетаются в разные стороны.
В жидкостях молекулы не так крепко соединены и дают возможность перемещаться из одного положения в другое. А в газах, молекулы и вовсе не соединены друг с другом, поэтому легко разлетаются в разные стороны.
Какой же можно сделать вывод?
На доске таблица:
|
Твердые тела |
Жидкости |
Газы |
|
Брусок |
Вода |
Воздух |
|
Пенал |
Чай |
Природный газ |
|
Лёд |
Молоко |
Пар |
Показываю схематическое изображение молекул.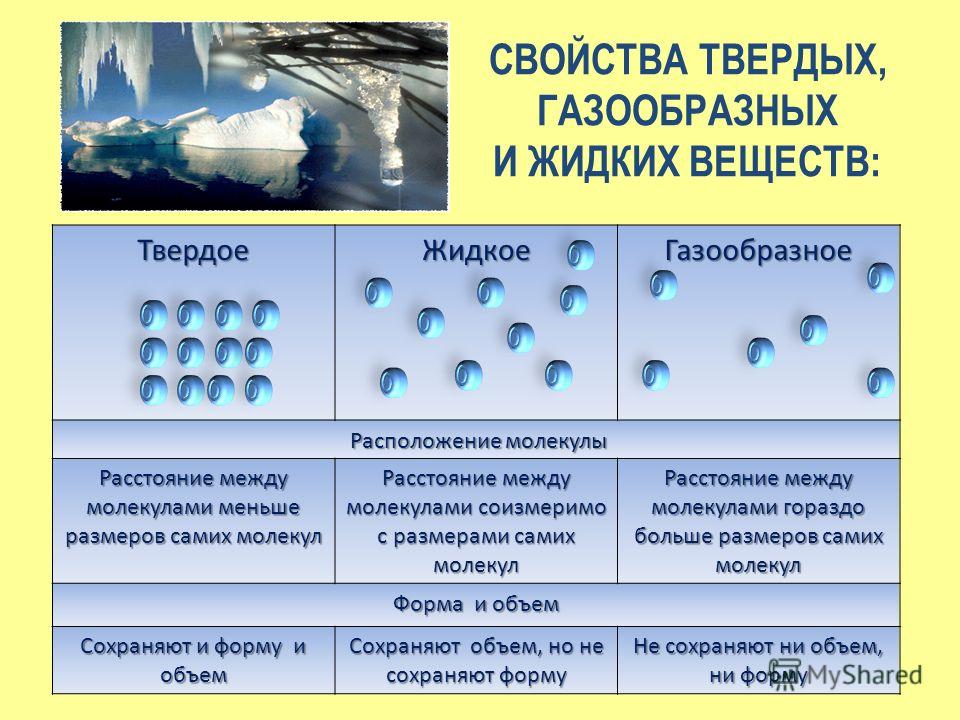
— Попробуйте определить эта схема каких тел? (каждая схема подставляется в столбики слов)
- Первичное закрепление знаний
На столе разные тела: чай в стакане, воздушный шар, сахар.
— Догадайтесь, к какой группе предметов относится чай? Сахар? Шарик с воздухом внутри?
- Постановка проблемы.
– Какое знакомое вам вещество может находиться во всех трех состояниях? (вода)
— А вот какие превращения происходят с водой мы узнаем на следующем уроке.
- Итог урока
— Что на уроке для вас было самым интересным?
— Что узнали сегодня на уроке?
— С какими основными состояниями тел мы сегодня с вами познакомились?
— Какими свойствами обладают твердые тела? Газообразные? Жидкие?
— Незнакомые жидкости нельзя пить и глотать и даже брать в руки.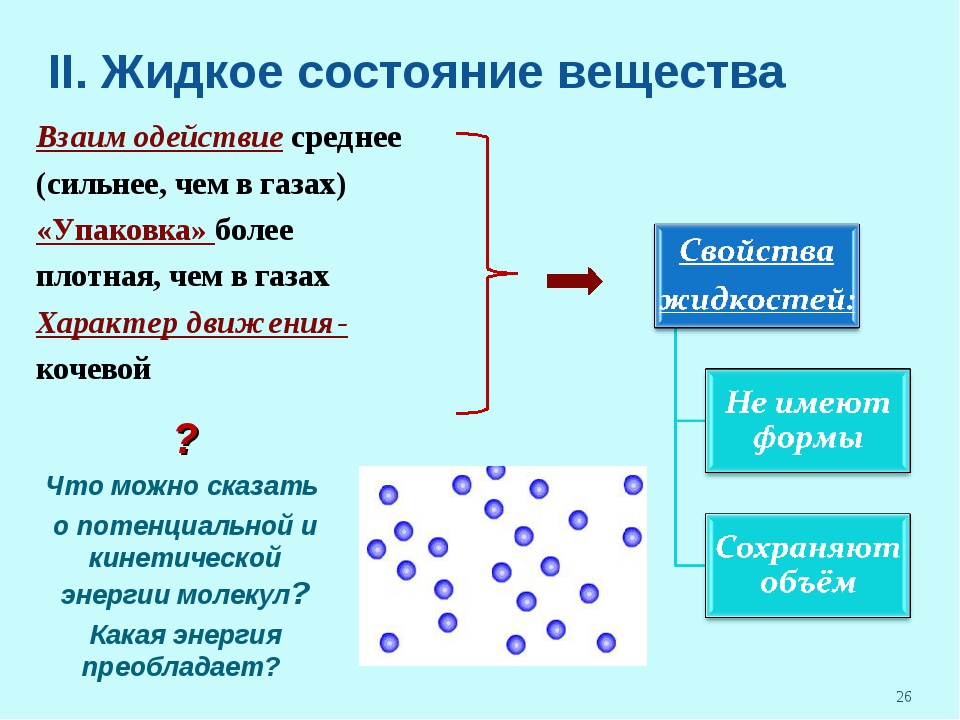 Это одно из правил разумного поведения.
Это одно из правил разумного поведения.
— Сегодня занимались все на отлично, особенно хочется отметить…, вашей работой я довольна, больше хочется активности от…, а теперь оцените себя сами в своих дневниках.
Домашним заданием будет: во время прогулки соберите веточки деревьев, с условием, что ломать деревья не будете. Мы их в классе поставим в разные стаканы и будем вести наблюдение за ними.
Огнетушитель порошковый ОП-5, АВСЕ (твердые, жидкие, газообразные вещества, электро установки), МИГ, 111-08
АБДЕЗИН-АКТИВ
АВЕСТИЛ УЛЬТРА
АКВА МИНЕРАЛЕ
АЛЬТСЕПТ ЭКСПРЕСС
АТМОСФЕРА ПРАЗДНИКА
БАРХАТНЫЕ РУЧКИ
Будьте Уверены
ВЕСЕЛАЯ ЗАТЕЯ
ВЕСЕЛЫЙ ХОРОВОД
ВОЛШЕБНЫЙ МИР
ВЫРАСТИ ДЕРЕВО!
ГАММА УВЛЕЧЕНИЙ
ГЛОБУСНЫЙ МИР
ГОРОД МАСТЕРОВ
ДЕСЯТОЕ КОРОЛЕВСТВО
ДЕТСКИЙ ЖЕМЧУГ
ЕМЕЛЬЯНЪ САВОСТИНЪ
ЗНАК КАЧЕСТВА
ЗОЛОТАЯ СКАЗКА
ЗОЛОТОЙ ИДЕАЛ
ИНТРОПЛАСТИКА
КАДРЫ В ПОРЯДКЕ
КОНЦЕПЦИЯ БЫТА
КОРОЛЕВСКАЯ ВОДА
КРАСНЫЙ ОКТЯБРЬ
ЛЮБИМЫЕ С ДЕТСТВА
МАТУШКА ПРИРОДА
МИРОВЫЕ ТЕТРАДИ
МИСТЕР МУСКУЛ
МИСТЕР ЧИСТЕР
МОЗАИКА-СИНТЕЗ
МОНЕТНЫЙ ДВОР
Манн, Иванов и Фербер
НАНО ЛАЙТ ПЛЮС
НЕВСКАЯ КОСМЕТИКА
НЕВСКАЯ ПАЛИТРА
НОВЕЙШИЕ ТЕХНОЛОГИИ
НЭФИС КОСМЕТИКС
ОБЪЕДИНЕННЫЕ КОНДИТЕРЫ
ОРАНЖЕВОЕ СОЛНЦЕ
ОСТРОВ СОКРОВИЩ
ОФИСНАЯ ПЛАНЕТА
ПОДОЛЬСК-АРТ-ЦЕНТР
ПРИНЦЕССА КАНДИ
ПРИНЦЕССА НУРИ
ПРИНЦЕССА ЯВА
ПРОСТАЯ НАУКА
ПРОФИТ/КУБИКА
РОЗОВЫЙ ФЛАМИНГО
РУССКИЕ ТРАВЫ
РЯЖСКАЯ ПЕЧАТНАЯ ФАБРИКА
СВЯТОЙ ИСТОЧНИК
СЛАДКИЕ ИСТОРИИ
СТИЛЬНЫЕ ШТУЧКИ
СТОЛИЧНЫЕ ШТУЧКИ
СУЛЬФОХЛОРАНТИН
ТРИНАТРИЙФОСФАТ
ТУАЛЕТНЫЙ УТЕНОК
ФЕНИКС-ПРЕМЬЕР
ФИЛЬКИНА ГРАМОТА
ЧЕСТНЫЙ БОЛЬШОЙ РУЛОНЧИК
ЧЕТЫРЕ СЕЗОНА
ЧИСТАЯ ЗВЕЗДА
Энергетическое образование
2.
 Фазовые переходы
Фазовые переходыАгрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств. В современной физике выделяют следующие агрегатные состояния: твёрдое тело, жидкость, газ, плазма (ранее им соответствовали 4 стихии (первоэлементы): Земля, Вода, Воздух, Огонь. Изменение агрегатного состояния — термодинамические процессы, являющиеся фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Понятие агрегатного состояния достаточно условно — существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью; высокоэластичные состояния некоторых полимеров, представляющие нечто среднее между стеклообразным и жидким состоянием, жидкие кристаллы и другие.
Твёрдое тело — cостояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Переход твердое вещество — жидкость.
Можно заставить жидкость перейти в твердое состояние, забрав у нее тепло. Для этого достаточно поместить ее в более холодную среду. При потере тепла молекулы жидкости замедляют свое движение и, в конце концов, уже не могут перемещаться, а просто колеблются вокруг фиксированных точек. С наступлением этой фазы жидкость отвердевает, т. е. превращается в твердое вещество. Например, вода замерзает при температуре 0°С. Большинство веществ кристаллизуются при переходе из жидкого состояния в твердое.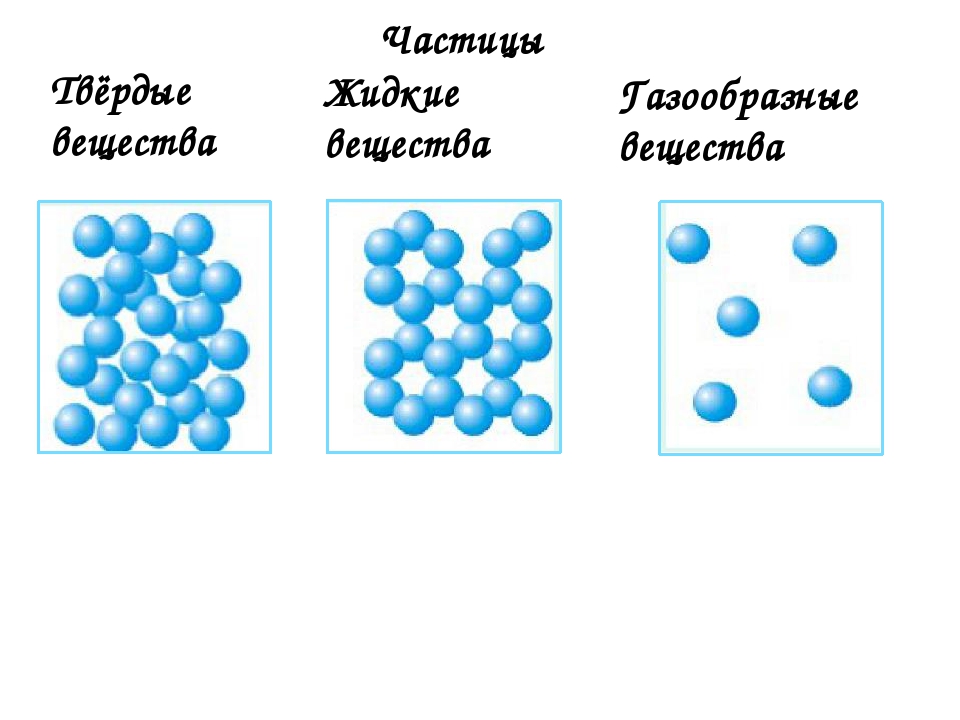 Так, NaCl (поваренная соль) образует кристаллы кубической формы. Нагреваясь, твердые вещества могут снова перейти в жидкое состояние, так как при этом увеличивается скорость движения их молекул. При нагревании твердого вещества с целью превращения в жидкость его температура растет за счет поглощения тепла. Но, достигнув точки плавления, температура вещества остается постоянной, хотя процесс поглощения тепла продолжается. Тепло, используемое для превращения твердого вещества в жидкость, не увеличивается после достижения точки плавления и называется скрытой теплотой плавления. Лишь после того, как все твердое вещество перейдет в жидкое состояние, его температура вновь начинает расти.
Так, NaCl (поваренная соль) образует кристаллы кубической формы. Нагреваясь, твердые вещества могут снова перейти в жидкое состояние, так как при этом увеличивается скорость движения их молекул. При нагревании твердого вещества с целью превращения в жидкость его температура растет за счет поглощения тепла. Но, достигнув точки плавления, температура вещества остается постоянной, хотя процесс поглощения тепла продолжается. Тепло, используемое для превращения твердого вещества в жидкость, не увеличивается после достижения точки плавления и называется скрытой теплотой плавления. Лишь после того, как все твердое вещество перейдет в жидкое состояние, его температура вновь начинает расти.
Жидкость. Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места.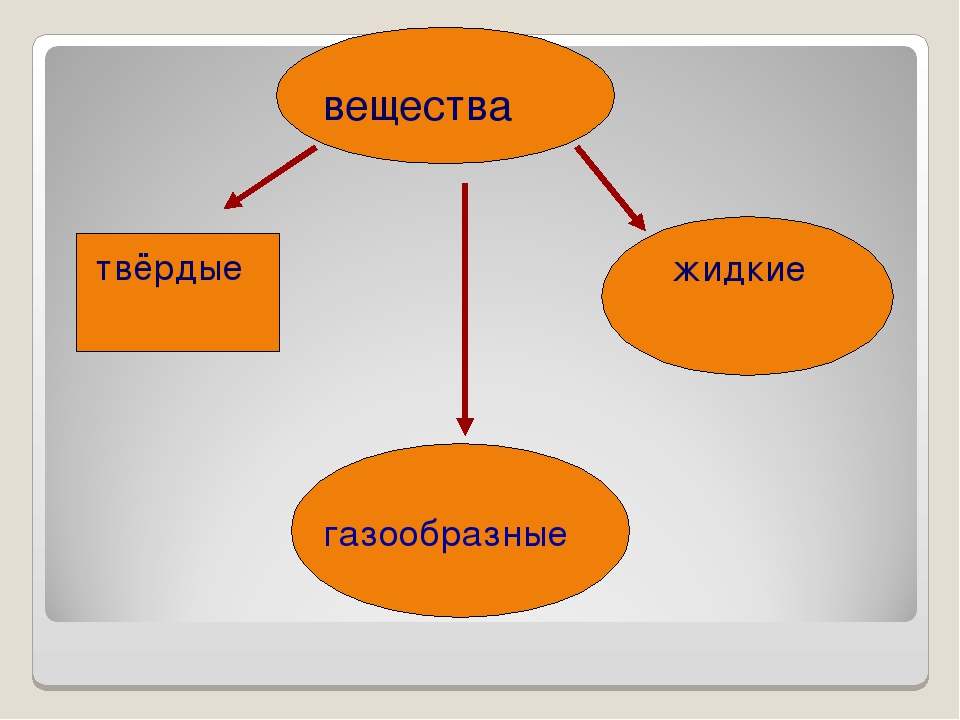 Присутствует только ближний порядок.
Присутствует только ближний порядок.
Переход жидкость — газ.
Если продолжать нагревать жидкость, ее температура будет расти до достижения точки кипения, после чего остается неизменной, так как превращение жидкости в газ требует большого количества тепла. Тепло, используемое для перехода жидкости в газообразное состояние, называется теплотой парообразования. Как только все вещество превратится в пар, его температура будет опять расти.
При охлаждении газа его температура вначале падает. Затем, после достижения точки кипения вещества, газ отдает свою теплоту парообразования и переходит в жидкое состояние при той же температуре. Только когда весь газ превратится в жидкость, температура вещества начинает падать.
Пар снова превращается в воду при определенной потере тепла. Это явление можно наблюдать при продолжительном кипении воды в чайнике. Холодные поверхности в помещении покрываются влагой, так как часть образовавшегося пара отдает им тепло при контакте. В результате молекулы пара замедляют движение, и он превращается в воду. Говорят, что пар конденсировался в жидкое состояние, а явление называют «конденсацией». Мы ошибочно считаем паром белые клубы у носика чайника, но настоящий пар нельзя увидеть. Видимые клубы состоят из крошечных капелек воды, образующихся при конденсации пара, когда на выходе из чайника он сталкивается с относительно холодным окружающим воздухом.
В результате молекулы пара замедляют движение, и он превращается в воду. Говорят, что пар конденсировался в жидкое состояние, а явление называют «конденсацией». Мы ошибочно считаем паром белые клубы у носика чайника, но настоящий пар нельзя увидеть. Видимые клубы состоят из крошечных капелек воды, образующихся при конденсации пара, когда на выходе из чайника он сталкивается с относительно холодным окружающим воздухом.
Газ. Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Прибор для демонстрации газовых законов представляет собой стеклянную колбу, соединенную вакуумными шлангами с гофрированным цилиндром, вакуумметром и вакуумным насосом. Для изменения объема гофрированного цилиндра последний соединен с рычагом. Все элементы смонтированы на несущей раме. У стеклянной колбы имеется еще один отросток — шлюзовая камера с двумя вакуумными кранами. Для показа опытов с насыщенными парами используем легко испаряющуюся жидкость — ацетон. Из системы откачиваем воздух и пережимаем шланг, ведущий к насосу, зажимом. Через шлюзовую камеру, чтобы в колбу не попал воздух, заливаем ацетон в таком количестве, чтобы на дне колбы образовалось немного жидкого ацетона. Вакуумметр показывает давление насыщенных паров ацетона. Медленно изменяем с помощью рычага объем гофрированного цилиндра. Стрелка вакуумметра стоит на одном месте. Это подтверждает тот факт, что давление насыщенных паров не зависит от объема. Закрепляем рычаг (фиксируем постоянный объем цилиндра) и спиртовым факелом подогреваем колбу. Давление насыщенных паров увеличивается.
У стеклянной колбы имеется еще один отросток — шлюзовая камера с двумя вакуумными кранами. Для показа опытов с насыщенными парами используем легко испаряющуюся жидкость — ацетон. Из системы откачиваем воздух и пережимаем шланг, ведущий к насосу, зажимом. Через шлюзовую камеру, чтобы в колбу не попал воздух, заливаем ацетон в таком количестве, чтобы на дне колбы образовалось немного жидкого ацетона. Вакуумметр показывает давление насыщенных паров ацетона. Медленно изменяем с помощью рычага объем гофрированного цилиндра. Стрелка вакуумметра стоит на одном месте. Это подтверждает тот факт, что давление насыщенных паров не зависит от объема. Закрепляем рычаг (фиксируем постоянный объем цилиндра) и спиртовым факелом подогреваем колбу. Давление насыщенных паров увеличивается.
Сублимация
Сублимация — переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое.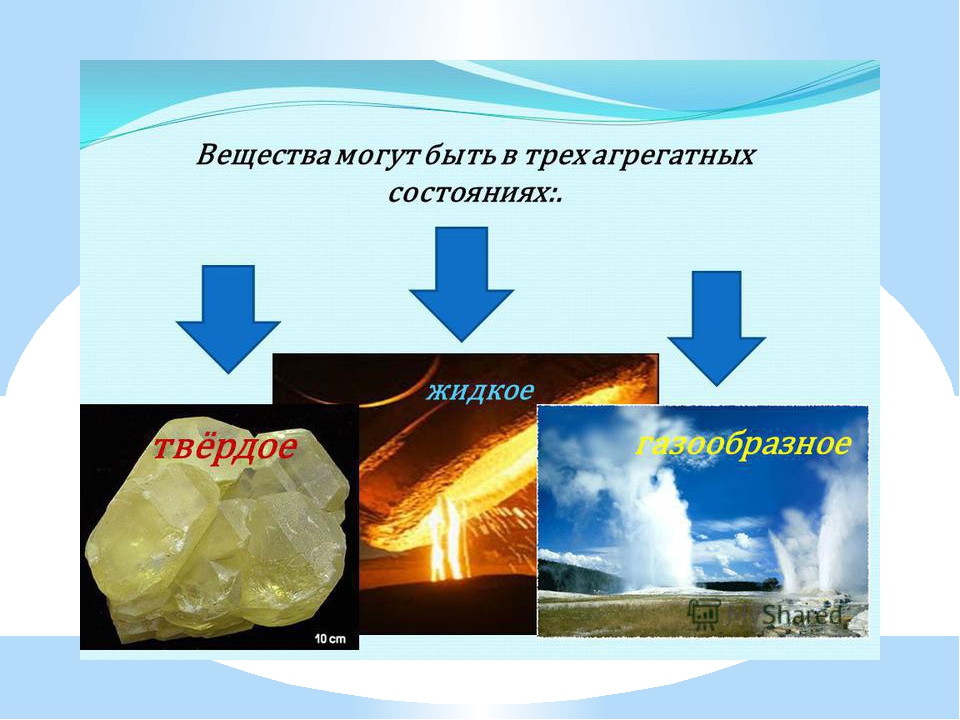 Хорошо поддается возгонке вода, что определило широкое применение данного процесса как одного из способов сушки. При промышленной возгонке сначала производят заморозку исходного тела, а затем помещают его в вакуумную или заполненную инертными газами камеру. Физически процесс возгонки продолжается до тех пор, пока концентрация водяных паров в камере не достигнет нормального для данной температуры уровня, в связи с чем избыточные водяные пары постоянно откачивают. Возгонка применяется в химической промышленности, в частности, на производствах взрывоопасных или взрывчатых веществ, получаемых осаждением из водных растворов.
Хорошо поддается возгонке вода, что определило широкое применение данного процесса как одного из способов сушки. При промышленной возгонке сначала производят заморозку исходного тела, а затем помещают его в вакуумную или заполненную инертными газами камеру. Физически процесс возгонки продолжается до тех пор, пока концентрация водяных паров в камере не достигнет нормального для данной температуры уровня, в связи с чем избыточные водяные пары постоянно откачивают. Возгонка применяется в химической промышленности, в частности, на производствах взрывоопасных или взрывчатых веществ, получаемых осаждением из водных растворов.
Возгонка также используется в пищевой промышленности: так, например, фрукты после сублимирования весят в несколько раз меньше, а восстанавливаются в воде. Сублимированные продукты значительно превосходят сушеные по пищевой ценности, так как возгонке поддаётся только вода, а при термическом испарении теряются многие полезные вещества. Перед сублимацией пищевых продуктов используется быстрое замораживание (-100 до -190 град.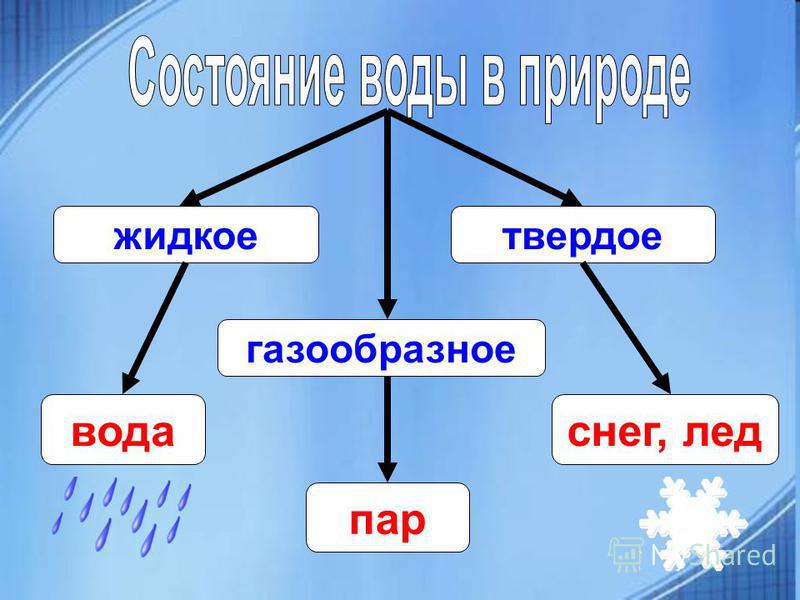 Цельсия), что приводит к образованию мелких кристаллов, не разрушающих клеточные мембраны.
Цельсия), что приводит к образованию мелких кристаллов, не разрушающих клеточные мембраны.
Кривая насыщения — линия, где происходит переход из одного агрегатного состояния в другое.
У разных веществ может одновременно происходить несколько изменений агрегатного состояния, например кипение одного с образованием кристаллической решетки у другого.
§ 6 Твердое, жидкое и газообразное состояния вещества » Народна Освіта
Свойства твердых, жидких и газообразных тел. Назовем все тела, изображенные на рисунках 6.1 и 6.2. Это как будто несложно: стол, мензурка и мерный стакан, колбы, рука человека, кусочек картона. Пожалуй, все!
Назовем все тела, изображенные на рисунках 6.1 и 6.2. Это как будто несложно: стол, мензурка и мерный стакан, колбы, рука человека, кусочек картона. Пожалуй, все!
Нет, возразите вы, названы только твердые тела, а есть еще жидкость в мерной посуде жидкие тела, газ в колбах — тела газообразные.
Обсудим некоторые особенности «поведения» газообразных и жидких тел, которые отличают их от тел твердых. Что произойдет, если перелить жидкость из стакана в цилиндр? Она примет форму цилиндра. И хотя может показаться, что объем воды при этом увеличился, мы знаем, что это иллюзия — он не изменился (рис. 6.1).
Проследим теперь за газообразным телом. В колбе, закрытой кусочком картона, находится газ рыжего цвета (рис. 6.2, а). Поместим сверху еще одну колбу и вытащим перемычку. Газ заполнит обе колбы (рис. 6.2, б). И форма, и объем газообразного тела изменились.
|
Рис. 6.2. Форма и объем газообразного тела изменяются: газообразные тела не сохраняют ни объем, ни форму. |
Мы выяснили, что свойства твердых тел, жидкостей и газов различны. Твердые тела сохраняют форму и объем. Жидкие тела сохраняют объем, но не сохраняют форму, принимая форму сосуда. Газообразные тела не сохраняют ни объем, ни форму, заполняя весь сосуд, в котором находятся.
От чего зависит способность тел сохранять или изменять форму и объем? От состояния вещества. Плотность газа очень мала, его молекулам просторно (рис. 6.3). Расстояния между молекулами намного больше размеров самих молекул. Они «носятся» с высокой скоростью, сталкиваясь друг с другом сравнительно редко. С такой «непоседливостью» молекулам газа достаточно легко заполнить любой объем.
Плотность жидкости намного больше плотности газа — молекулам жидкости тесно (рис. 6.4). Частицы не могут мчаться подобно частицам в газе: им мешают соседи. Молекула «мечется» вокруг одной и той же точки. Перемещения молекул жидкости намного меньше тех, которые совершают молекулы в газах. Ро с?£Оо°о
Ро с?£Оо°о
Рис. 6.4. Расположение молекул в жидкости
Рис. 6.5. Поверхность жидкости всегда горизонтальна
|
Рис. 6.6. Атомы или молекулы вещества в твердом состоянии расположены в определенном порядке |
вокруг своего места. Вот почему твердые тела сохраняют форму и объем.
Все ли вещества могут существовать в разных состояниях — твердом, жидком, газообразном? Твердое, жидкое и газообразное состояния вещества называются агрегатными состояниями. Нам известны агрегатные состояния воды — твердое (лед), жидкое (собственно вода) и газообразное (пар). Существуют ли они для других веществ? Ведь мы привыкли, что железо твердое, растительное масло жидкое, а кислород — газ.
Вспомним: вода изменяет агрегатные состояния при нагревании и охлаждении. Такое же свойство имеют и другие вещества. Железо при нагревании до очень высокой температуры +1539 °С превращается в жидкость (рис. 6.7), а при +3200 °С становится газообразным. Газ азот — составная часть воздуха — при охлаждении до температуры -210 °С превращается в жидкость. Такие низкие температуры можно получить в лабораториях. Хранят жидкий азот в специальных сосудах. На рисунке 6.8 видно, как из такого сосуда вытекает струя. Вокруг — мельчайшие капли воды, образовавшиеся из водяного пара воздуха под воздействием очень низкой температуры азота. Открыв такой сосуд с азотом при комнатной температуре, мы вскоре обнаружим, что он опустел. Жидкий азот испарился — перешел в газообразное состояние.
6.7), а при +3200 °С становится газообразным. Газ азот — составная часть воздуха — при охлаждении до температуры -210 °С превращается в жидкость. Такие низкие температуры можно получить в лабораториях. Хранят жидкий азот в специальных сосудах. На рисунке 6.8 видно, как из такого сосуда вытекает струя. Вокруг — мельчайшие капли воды, образовавшиеся из водяного пара воздуха под воздействием очень низкой температуры азота. Открыв такой сосуд с азотом при комнатной температуре, мы вскоре обнаружим, что он опустел. Жидкий азот испарился — перешел в газообразное состояние.
Температуры, при которых происходит изменение агрегатного состояния, у всех веществ различны (вспомните, например, при какой температуре плавится лед, а при какой — железо). Температура на поверхности Земли может изменяться в пределах от -80 °С до +50 °С. Для множества веществ такие колебания температуры не приводят к изменению их агрегатного состояния. Вот почему мы обычно сталкиваемся с твердым железом и газообразными кислородом, азотом, водородом.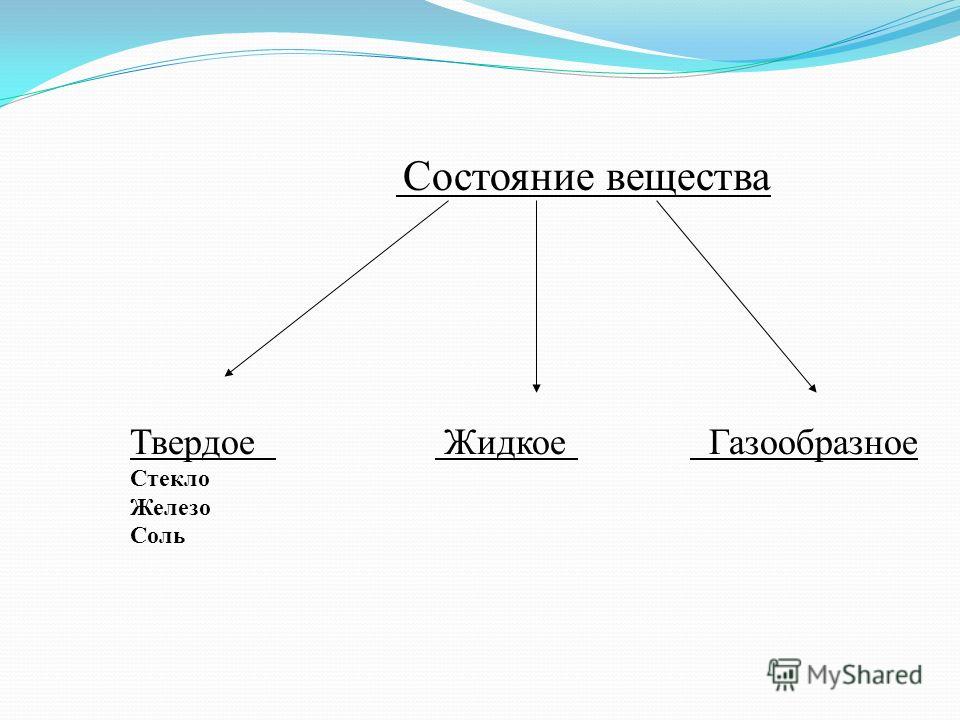
• Твердые тела сохраняют и форму, и объем. Жидкие тела сохраняют объем, но не сохраняют форму. Газообразные тела способны изменять и форму, и объем.
• Жидкое, твердое и газообразное состояния вещества называются агрегатными состояниями вещества.
• Все вещества могут находиться в разных агрегатных состояниях. Изменяет или сохраняет тело объем и форму, зависит от агрегатного состояния вещества, из которого состоит тело.
Наила лаборатория ________
Комментируем результаты опытов.
1. В стакан налили воду и взвесили его. Затем накрыли крышкой и поместили в морозильную камеру. Когда вода замерзла, то есть превратилась в твердое тело, стакан поставили на весы.
• Сравните показания весов (рис. 6.9).
• Согласны ли вы с тем, что при переходе из жидкого состояния в твердое масса воды не изменяется?
2. В небольшой сосуд налили спирт, сосуд поместили в банку, банку плотно закрыли (рис. 6.10). Эту «экспериментальную установ-
ку» взвесили. Ее масса равна 1 кг 350 г. Банку поставили возле батареи. Через некоторое время обнаружили, что сосуд пуст.
Ее масса равна 1 кг 350 г. Банку поставили возле батареи. Через некоторое время обнаружили, что сосуд пуст.
«Экспериментальную установку» повторно взвесили. Весы вновь показали, что ее масса равна 1 кг 350 г.
• Почему не изменилась масса установки?
• Как вы думаете, исчез ли спирт?
Сопоставьте результаты опытов с водой и со спиртом. Согласны ли вы со следующим выводом: «При переходе вещества из одного агрегатного состояния в другое масса тела не изменяется»?
3. Изменяется ли объем воды при переходе из жидкого в твердое состояние?
Рассмотрите схему опыта (рис. 6.11). В мерный цилиндр налили воду, измерили ее объем и отметили его черточкой на цилиндре.
Воду перелили в пластиковый стакан и заморозили. Затем измерили объем льда, опустив его в растительное масло. Когда лед растаял, измерили объем масла и талой воды. Затем вычислили объем талой воды.
• Сравните результаты измерений: объем воды до затвердения, объем льда и объем талой воды.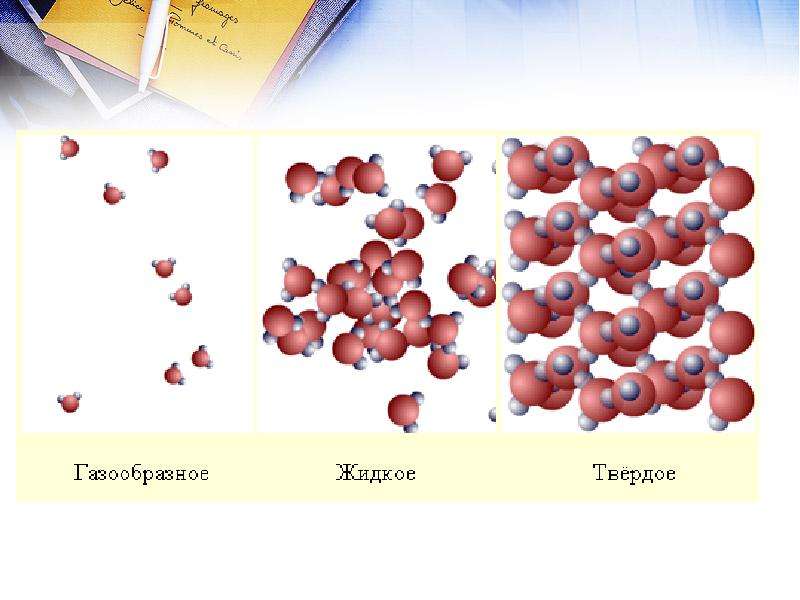 В каком случае объем был самым большим?
В каком случае объем был самым большим?
« Согласны ли вы с утверждением: «При переходе воды из жидкого состояния в твердое (лед) объем воды увеличивается»?
Запомним:
Вода — вещество, объем которого увеличивается при затвердевании и уменьшается при переходе в жидкое состояние. Другие вещества ведут себя иначе: при переходе из твердого состояния в жидкое их объем увеличивается, а при затвердевании уменьшается.
|
Рис. 6.11 а) Объем воды до затвердевания 50 мл б) Объем растительного масла 100 мл в) Объем растительного масла с кусочком льда 155 мл. Объем льда: 155 — 100 = 55 (мл) г) Объем растительного масла и талой воды 150 мл. Объем талой воды: 150 — 100 = 50 (мл) |
Проверьте себя
1. Дополните предложения:
«Жидкие тела сохраняют объем, однако не сохраняют….» «Газообразные тела не сохраняют.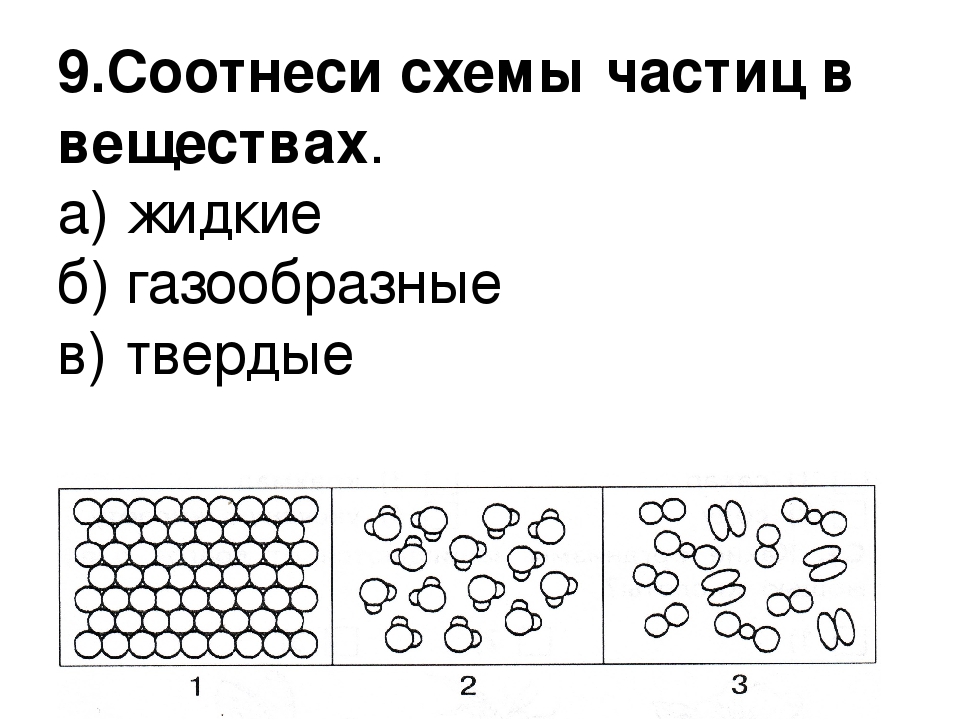 .. и не сохраняют….»
.. и не сохраняют….»
«Твердые тела сохраняют и …, и объем.»
2. Пользуясь рисунками 6.3, 6.4 и 6.6, расскажите о взаимном расположении и движении молекул в жидких, газообразных и твердых телах.
3. Почему газообразные тела изменяют объем, а жидкости — нет?
4. Дополните схему изменения агрегатного состояния вещества:
5. Определите, каким был объем воздуха в шприце до того, как нажали на поршень, и после этого. Почему объем воздуха можно изменить (рис. 6.12)?
6. Катя нарисовала схему, которая показывает, как были расположены молекулы газов воздуха, когда поршень шприца находился в положении айв положении б (рис. 6.12). Свои схемы нарисовали Максим и Стас. Какая из схем правильная (рис. 6.13)?
7. Как изменяется плотность воды при замерзании? Для ответа воспользуйтесь выводами опытов 1 и 3.
Это материал из учебника Природоведение 5 клас Т.И. Базанова
Разница между твердым, жидким и газообразным
Все, что нас окружает, такие как воздух, еда, вода, растения, животные, транспортные средства, одежда и т. Д., Состоит из материи. Вещество — это совокупность частиц, и все, что имеет массу и занимает пространство. Существует три основных состояния вещества: твердое, жидкое и газообразное. Состояния вещества происходят из-за изменений в молекулах вещества. Размер и форма твердого объекта являются определенными.
Д., Состоит из материи. Вещество — это совокупность частиц, и все, что имеет массу и занимает пространство. Существует три основных состояния вещества: твердое, жидкое и газообразное. Состояния вещества происходят из-за изменений в молекулах вещества. Размер и форма твердого объекта являются определенными.Тем не менее, если мы говорим о двух других состояниях вещества, то есть жидкости и газа, то жидкости текут, принимая форму стакана, и газы диффундируют, чтобы полностью заполнить имеющийся объем. Основное различие между твердым телом, жидкостью и газом заключается в их свойствах, которые мы собираемся обсудить в этой статье.
Сравнительная таблица
| Основа для сравнения | твердый | жидкость | газ |
|---|---|---|---|
| Имея в виду | Твердый относится к форме вещества, которое имеет структурную жесткость и имеет твердую форму, которую нельзя легко изменить. | Жидкость — это вещество, которое свободно течет, имеет определенный объем, но не имеет постоянной формы. | Газ относится к состоянию вещества, не имеет какой-либо формы, но полностью соответствует форме контейнера, в который он помещен. |
| Форма и Объем | Фиксированная форма и объем. | Нет фиксированной формы, но имеет объем. | Ни определенной формы, ни объема. |
| энергии | низший | Средняя | Наибольший |
| сжимаемость | Сложно | Почти сложно | Легко |
| Расположение молекул | Регулярно и тесно организовано. | Случайно и немного редко устроены. | Случайный и более редкий. |
| жидкотекучесть | Не может течь | Потоки с более высокого уровня на более низкий. | Протекает во всех направлениях. |
| Молекулярное движение | Незначительное молекулярное движение | Броуновское молекулярное движение | Свободное, постоянное и случайное молекулярное движение. |
| Межмолекулярное пространство | Очень меньше | Больше | большой |
| Межмолекулярное притяжение | максимальная | Средняя | минимальный |
| Скорость звука | Самый быстрый | Быстрее, чем газ, но медленнее, чем твердый | Самый низкий среди всех |
| Место хранения | Не нужен контейнер для хранения. | Не может храниться без контейнера. | Необходим закрытый контейнер для хранения. |
Определение твердого тела
Под термином «твердый» мы понимаем тип материи, которая имеет жесткую структуру и противостоит изменению ее формы и объема. Частицы твердого тела плотно связаны и хорошо расположены в правильном порядке, что не позволяет частицам свободно перемещаться из одного места в другое. Частицы постоянно вибрируют и крутятся, но движения нет, так как они находятся слишком близко друг к другу.
Как межмолекулярное притяжение максимально в твердых телах, так и потому, что их форма фиксирована, а частицы остаются там, где они установлены. В дополнение к этому сжатие твердого тела очень жесткое, так как пространства между молекулами уже очень меньше.
Определение жидкости
Свободно текучее вещество постоянного объема, имеющее консистенцию, называется жидкостью. Это тип материи, который не имеет своей формы, но принимает форму сосуда, в котором он находится.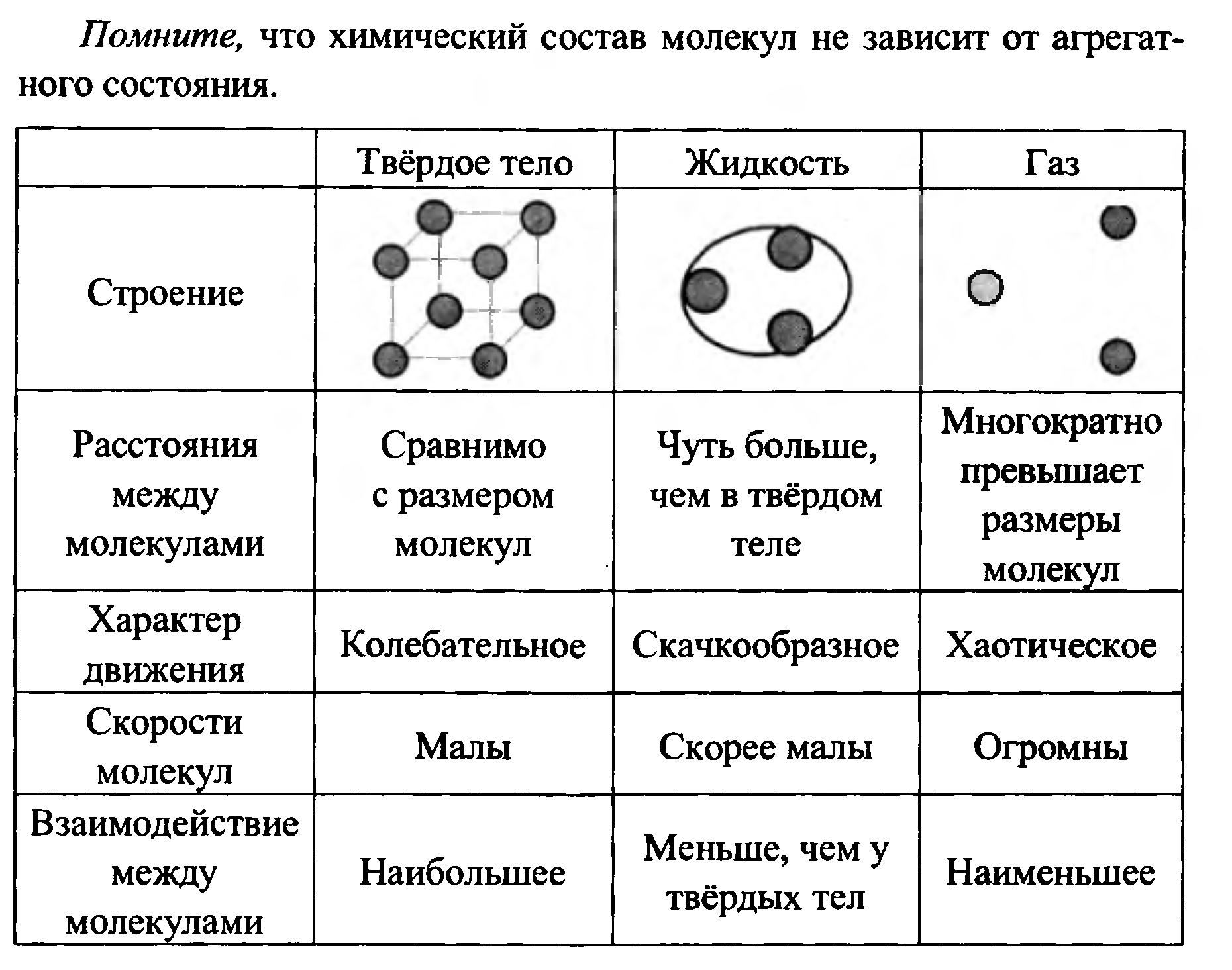 Он содержит мелкие частицы, которые крепко удерживаются межмолекулярными связями. Одним из уникальных свойств жидкости является поверхностное натяжение, явление, при котором жидкость обладает минимальной площадью поверхности.
Он содержит мелкие частицы, которые крепко удерживаются межмолекулярными связями. Одним из уникальных свойств жидкости является поверхностное натяжение, явление, при котором жидкость обладает минимальной площадью поверхности.
Сжатие жидкости практически затруднено из-за меньшего зазора между частицами. Частицы тесно связаны, но не так тесно, как в случае твердого тела. Таким образом, частицы могут двигаться и смешиваться друг с другом.
Определение газа
Газ описывается как состояние вещества, которое свободно распространяется во всех направлениях и заполняет все доступное пространство, независимо от количества. Он состоит из частиц, которые не имеют определенной формы и объема. Частицы могут быть отдельными атомами или элементарными молекулами или составными молекулами.
В газах молекулы слабо удерживаются, и поэтому между молекулами много свободного пространства для свободного и постоянного движения. Благодаря этой характеристике, газ обладает способностью заполнять любой контейнер, а также может быть легко сжат.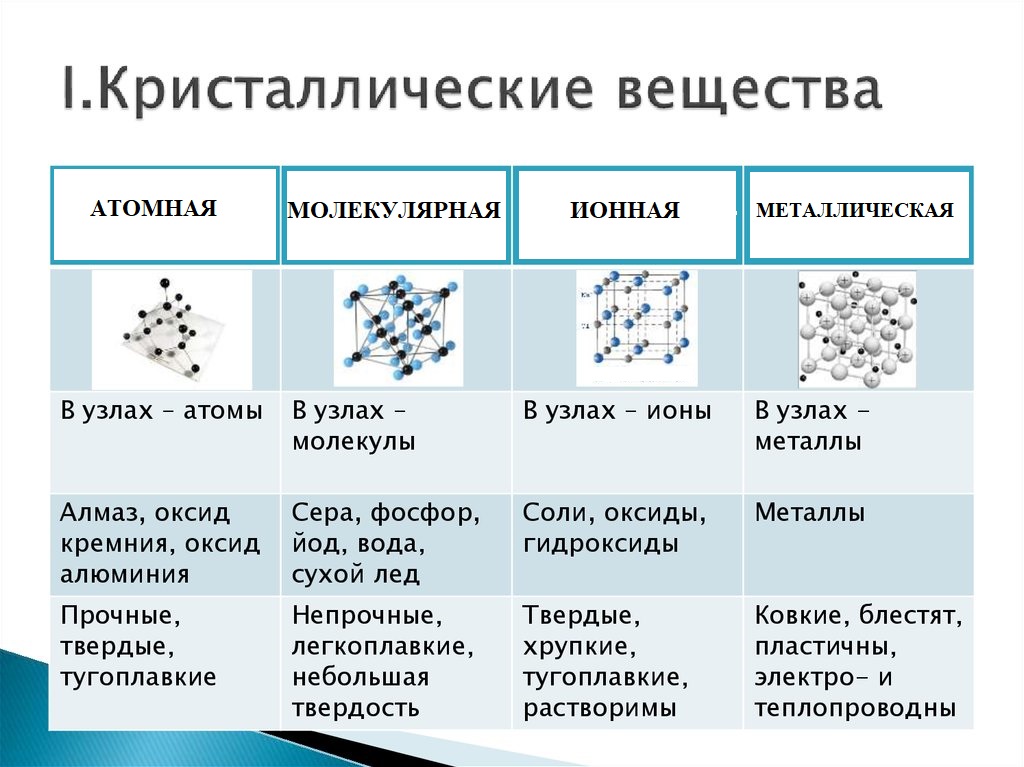
Основные различия между твердым веществом, жидкостью и газом
Разница между твердым веществом, жидкостью и газом может быть четко определена по следующим причинам:
- Вещество, обладающее структурной жесткостью и имеющее твердую форму, которую трудно изменить, называется твердым веществом. Водоподобная жидкость, которая течет свободно, имеет определенный объем, но не имеет постоянной формы, называется жидкостью. Газ относится к состоянию вещества, не имеет какой-либо формы, но полностью соответствует форме контейнера, в который он помещен.
- Хотя твердые вещества имеют определенную форму и объем, жидкости имеют только определенный объем, но не форму, газы не имеют ни формы, ни объема.
- Уровень энергии самый высокий в газах, средний в жидкости и самый низкий в твердых веществах.
- Сжатие твердых частиц затруднено, жидкости почти несжимаемы, но газы легко сжимаются.
- Молекулярное расположение твердых веществ является регулярным и близким, но жидкости имеют неправильное и редкое молекулярное расположение, а газы также имеют случайное и более редкое расположение молекул.

- Молекулярное расположение в твердых телах хорошо организовано. Однако в случае жидкостей слои молекул скользят и скользят друг над другом. Напротив, частицы в газах совсем не организованы, из-за чего частицы движутся случайно.
- Когда дело доходит до текучести, твердые вещества не могут течь, однако жидкости могут течь, и это также от более высокого уровня до более низкого уровня. В отличие от этого газы текут во всех направлениях.
- Пространства между молекулами и кинетической энергией минимальны в твердых телах, средние в жидких и максимальные в газах. Таким образом, движение молекул незначительно в твердых телах, тогда как в жидкостях наблюдается беспорядочное, случайное движение молекул. В отличие от газов, которые имеют свободное, постоянное и случайное движение молекул.
- В твердых телах частицы плотно удерживаются сильным межмолекулярным притяжением, хотя в жидкостях притяжение между частицами является промежуточным. В отличие от этого частицы слабо удерживаются, потому что межмолекулярное притяжение слабое.

- Скорость звука самая высокая в твердых телах, а скорость немного ниже в жидкостях и минимальная в газах.
- Поскольку твердые вещества имеют определенную форму и размер, им не требуется контейнер для хранения. Жидкости нельзя хранить без контейнера. И наоборот, для хранения газов необходим закрытый контейнер.
Изменение в состоянии материи
Вещество меняет свое состояние от одной формы к другой, когда нагревается или охлаждается, что подпадает под физическое изменение. Итак, ниже приведены некоторые процессы, посредством которых состояние вещества может быть изменено:
- Плавление : процесс превращения твердого вещества в жидкость.
- Замораживание : процесс, который помогает в превращении жидкости в твердое вещество.
- Испарение : процесс, используемый для превращения жидкости в газ.
- Конденсация : процесс, при котором газ превращается в жидкость.
- Сублимация .
 Когда твердое вещество превращается в газ, оно называется сублимацией.
Когда твердое вещество превращается в газ, оно называется сублимацией. - Описание : процесс, посредством которого газ превращается в твердое вещество.
Заключение
Следовательно, в этой статье мы узнали, что вещество присутствует в трех состояниях: твердое тело, жидкость и газ. Кроме того, состояние вещества являются взаимозаменяемыми, то есть форма может быть изменена путем изменения температуры или давления.
Состояния воды в природе: условия перехода, необычные факты
Удивительная вода: FreepickИзвестные человечеству состояния воды не ограничиваются тремя базовыми вариантами, о которых большинство слышало в школе. Как создать горячий лед или сухую воду? Возможно ли наблюдать воду сразу жидкой, твердой и газообразной? Как на эти и многие другие вопросы отвечает наука?
Три состояния воды в природе
Воду как прозрачную жидкость, у которой отсутствует запах и вкус, знают все. Но только ли такой она бывает? Прежде чем ответить на вопрос о том, каковы возможные агрегатные состояния воды, выясним, что такое агрегатное состояние.
В физике под этим понятием подразумевают состояние вещества, обусловленное определенной температурой и давлением. Науке известно:
- газообразное;
- твердое;
- жидкое состояние вещества.
При этом одно и то же вещество может менять свое состояние в зависимости от условий окружающей среды.
Хорошо известны три агрегатных состояния воды:
- Твердое состояние воды (лед). В этом состоянии частички воды имеют друг с другом сильную взаимосвязь. Кубик льда хорошо сохраняет форму, он довольно прочный и твердый на ощупь.
- Жидкое состояние. В нем частицы теряют строгую упорядоченность. Связи между ними разрушаются, а жидкость принимает форму того сосуда, в который она помещена. Однако молекулы все еще располагаются достаточно близко друг к другу.
- Газообразное состояние воды (пар). В этом состоянии частички максимально беспорядочно двигаются, а расстояния между ними становятся очень большими.
Состояние воды прямо связано с температурой.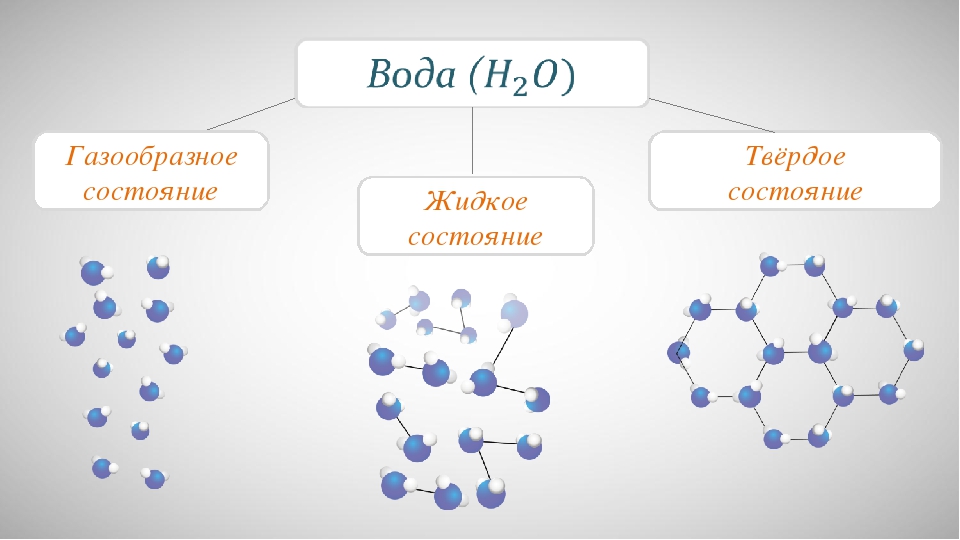 Эта жидкость обладает уникальным свойством: свое жидкое состояние она сохраняет в широком диапазоне от 0 до 100 °С. В верхней точке начинается закипание с постепенным переходом в газообразную фазу. При снижении температуры ниже 0 °С происходит образование льда.
Эта жидкость обладает уникальным свойством: свое жидкое состояние она сохраняет в широком диапазоне от 0 до 100 °С. В верхней точке начинается закипание с постепенным переходом в газообразную фазу. При снижении температуры ниже 0 °С происходит образование льда.
При этом в природе можно часто увидеть, как вода и лед соседствуют друг с другом, а в этом время над ними витает невидимый глазу водяной пар. Благодаря таким удивительным способностям воды происходит ее постоянный круговорот в природе.
Жидкое состояние воды: FreepickЕсли рассматривать все три состояния воды, то жидкое остается одним из наиболее важных. Жидкая вода служит универсальным растворителем для множества других веществ, является основным компонентом организма человека и средой для протекания всех химических процессов.
Более того, именно у жидкой воды ученым удалось обнаружить дополнительные состояния — «обычная» и «аномальная» вода. Последняя образуется при температуре –63 °С и может находиться в одном из двух состояний:
- иметь низкую плотность при низком давлении;
- иметь высокую плотность при высоком давлении.

Две эти жидкости заметно различаются по свойствам, а их плотность отличается на 20%, поэтому они не могут смешиваться между собой. Как ученым удалось уловить эти состояния, ведь хорошо известно, что происходит с водой при замерзании: она переходит в твердую фазу — в лед?
Авторам исследования понадобились специальные приборы. С помощью инфракрасного лазера лед нагревали, при этом образовывалась жидкая вода с высокой плотностью, а давление сохраняли повышенным.
За этим процессом вели наблюдение рентгеновским лазером. Было замечено образование пузырьков «аномальной» воды. Появлялись они на крайне маленький промежуток времени: были видны до 3-х микросекунд.
Эти исследования доказали, что ученым еще далеко не все известно о воде, хотя мы и сталкиваемся с ней ежедневно и ежечасно. Ее свойства продолжают изучать и открывать новые грани.
Состояния воды: необычные факты
Твердое состояние воды (лед): FreepickУченым оказалось недостаточно трех агрегатных состояний воды, поэтому они изобрели целый ряд необычных вариантов и продолжают работать в этом направлении.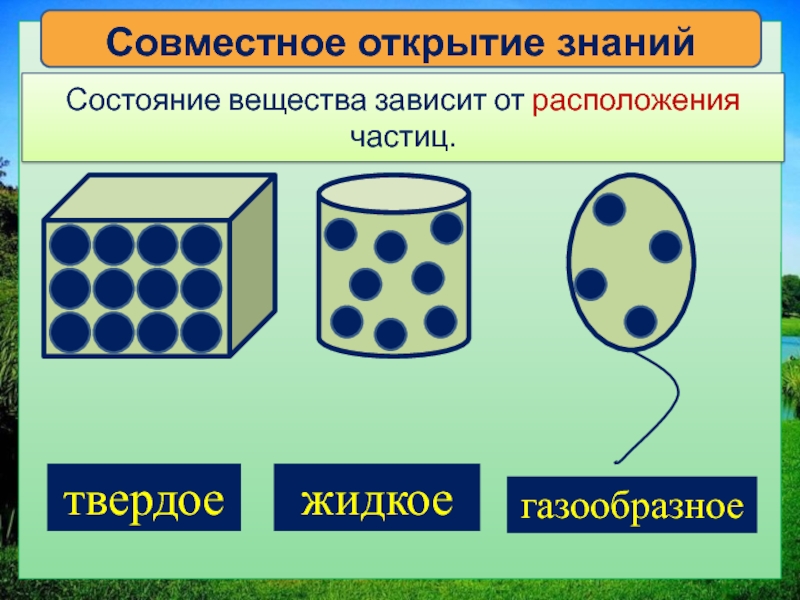
Лед VII (горячий лед)
Для обычного холодного льда используется обозначение «лед Ih». Когда при нормальном давлении снижается температура и вода замерзает, то атомы кислорода в ее молекулах образуют шестигранники.
Если же давление будет возрастать, то можно получить лед VII, атомы которого располагаются в виде куба. Он очень противоречив:
- Этот лед горячий, так как формируется в необычных условиях.
- На Земле он мог бы образоваться глубоко под мантией, в области высокого давления.
- Но там и температура очень высока, из-за чего вода сразу же испаряется.
Ученым удалось создать такой лед в лаборатории. Кроме того, он был обнаружен в алмазах, которые нашли в недрах нашей планеты.
Сухая вода
Ее получают путем смешивания обычной воды и двуокиси кремния. Несмотря на то что жидкости в ней 25%, она является сухим веществом. Сахарообразные крупинки внутри содержат воду, а сверху покрыты оксидом кремния.
Сухую воду создали в 1968 для нужд косметологии.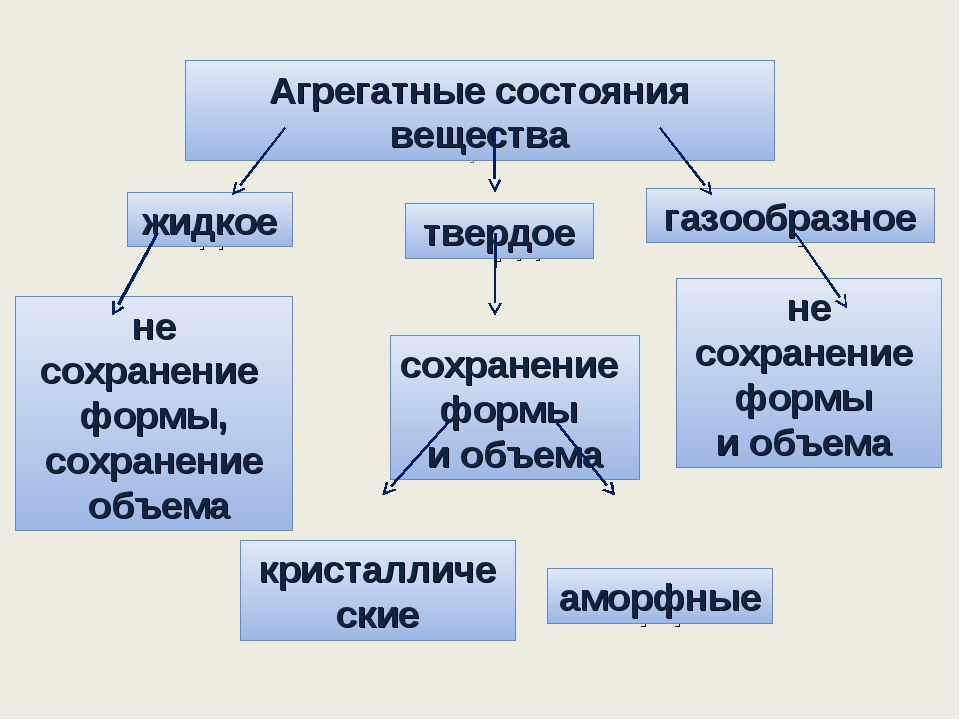 Затем о ней забыли, а сейчас рассматривают варианты использования для поглощения углекислого газа, чтобы хранить и транспортировать химикаты.
Затем о ней забыли, а сейчас рассматривают варианты использования для поглощения углекислого газа, чтобы хранить и транспортировать химикаты.
Сверхзвуковой лед
Этот лед также называют льдом XVIII. Он образуется при очень сильном повышении давления и температурных показателей — до тысяч градусов и миллионов атмосфер. В горячем плотном и черном на виде веществе узнать лед очень трудно.
Получить его экспериментально удалось совсем недавно с применением мощных лазеров, которые создавали ударные волны, мгновенно повышая температуру и давление. При этом происходило разделение атомов водорода и кислорода с параллельным образованием твердых кристаллов.
Сверхкритическая вода
Вода может стать такой из газообразного состояния. Это очень странный пар, который нельзя назвать газом. Образование такой воды происходит при 373 °С и давлении 220 бар. Снова жидкой она уже стать не может. Такая вода способна проходить сквозь твердые вещества, как газы, и быть растворителем подобно жидкости.
Аморфный лед
Этот лед получается при мгновенном охлаждении воды, когда молекулы не кристаллизуются, как следует. Получается своеобразное стекло — очень медленно движущаяся жидкость.
На нашей планете аморфный лед встречается редко, а вот на просторах Вселенной вода часто существует в этом состоянии.
Тройная точка воды
В этой точке вещество одновременно существует как твердое, жидкое и газообразное. Такое специфическое равновесие достигается путем сочетания показаний давления и температуры. Для воды они составляют 0,01 °С и 0,0060366 атмосфер.
Эта точка применяется, когда определяется температура по Кельвину, калибруются термометры и определяются тройные точки для других жидкостей. Из тройной точки воду можно перевести в любое из ее возможных агрегатных состояний.
Горящий лед
Это не чистая вода, а сочетание воды и метана, которое способно гореть, словно бумага. Такой лед образуется в результате естественных процессов в океанских глубинах, в зонах вечной мерзлоты, может засорить нефтепровод или газопровод.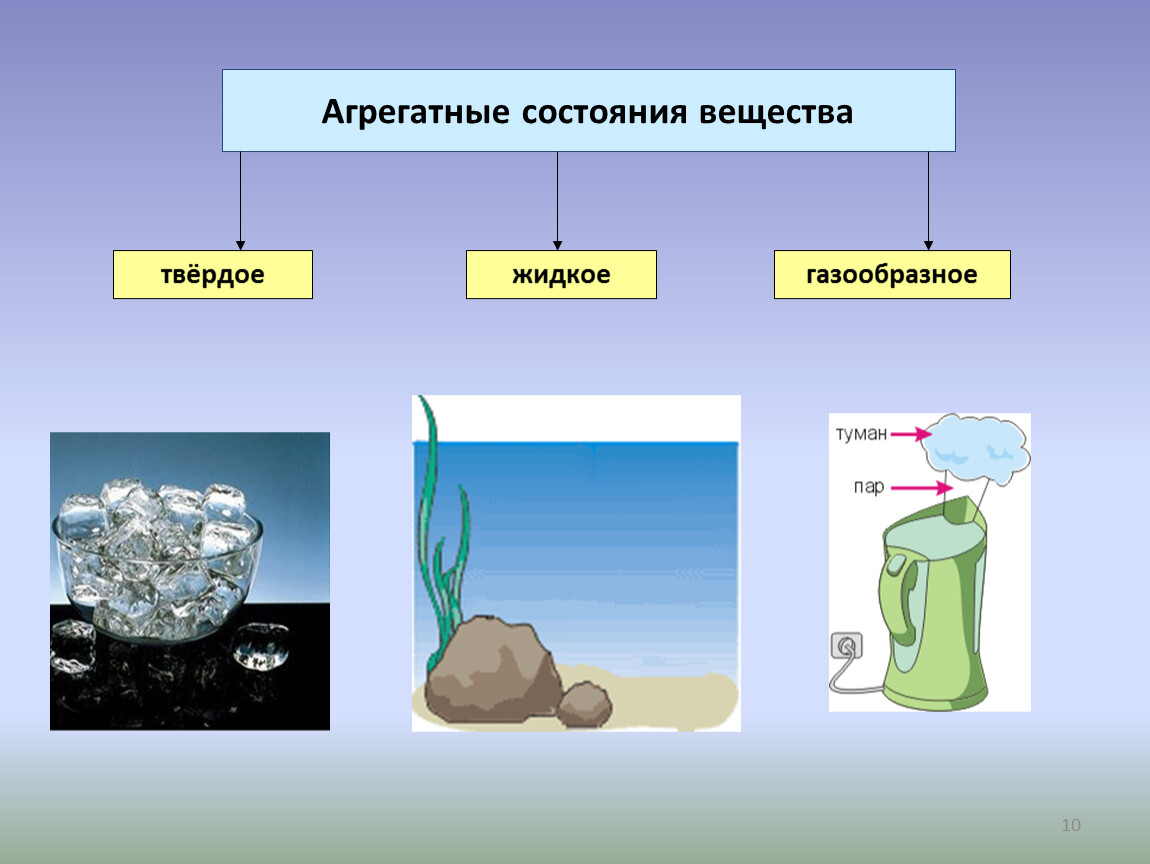
При его формировании вначале замораживается метан, который постепенно покрывает настоящий лед. Ученые рассматривают его как чистый и экологичный источник топлива.
Таковы обычные и нестандартные состояния воды. Природа отменно поработала, чтобы создать такое чудо, но и ученые не остались в стороне. Они до сих пор работают над получением воды в уникальных состояниях.
Оригинал статьи: https://www.nur.kz/family/school/1904441-sostoyaniya-vody-v-prirode-usloviya-perehoda-neobychnye-fakty/
Газы, жидкости и твердые вещества
Газы, жидкости и твердые вещества Газы, жидкости и твердые веществаГазы, жидкости и твердые тела состоят из атомов, молекул и / или ионы, но поведение этих частиц различается в трех фазах. На следующем рисунке показаны микроскопические различия.
| Вид газа под микроскопом. | Вид жидкости под микроскопом. | Изображение твердого тела под микроскопом. |
Обратите внимание, что:
- Частиц в:
- газ хорошо разделены без штатной договоренности.
- жидкости находятся близко друг к другу, не располагая регулярным расположением.
- solid плотно упакованы, как правило, равномерно.
- Частиц в a:
- газ колеблется и свободно перемещается на высоких скоростях.
- жидкости вибрируют, перемещаются и скользят друг мимо друга.
- твердые вибрируют (покачиваются), но обычно не перемещаются с места на место.
В следующей таблице приведены свойства газов, жидкостей и твердых тел. и определяет микроскопическое поведение, отвечающее за каждое свойство.
| Некоторые характеристики газов, жидкостей и твердых тел и микроскопического объяснения поведения | ||
|---|---|---|
| газ | жидкость | цельный |
| принимает форму и объем своего контейнера частиц могут перемещаться друг мимо друга | принимает форму той части контейнера, которую он
занимает частиц могут перемещаться / скользить друг мимо друга | сохраняет фиксированный объем и форму жесткий — частицы заблокированы на месте |
| сжимаемый много свободного пространства между частицами | нелегко сжимается Мало свободного пространства между частицами | нелегко сжимается Мало свободного пространства между частицами |
| легко течет частиц могут перемещаться друг мимо друга | течет легко частиц могут перемещаться / скользить друг мимо друга | не течет легко жесткий — частицы не могут двигаться / скользить мимо еще |
2.\ text {o} \ text {C} \), вода — это газ (пар). Состояние воды зависит от температуры. Каждое состояние (твердое, жидкое и газообразное) имеет свой уникальный набор физических свойств. Материя обычно находится в одном из трех состояний:
твердое , жидкое или газ . Рисунок \ (\ PageIndex {1} \): Материя обычно подразделяется на три классических состояния, с добавлением плазмы в качестве четвертого состояния. Слева направо: кварц (твердое тело), вода (жидкость), диоксид азота (газ).Состояние данного вещества также является его физическим свойством. Некоторые вещества существуют в виде газов при комнатной температуре (кислород и углекислый газ), в то время как другие, такие как вода и металлическая ртуть, существуют в виде жидкостей. Большинство металлов существует в твердом виде при комнатной температуре. Все вещества могут существовать в любом из этих трех состояний. На рисунке \ (\ PageIndex {2} \) показаны различия между твердыми телами, жидкостями и газами на молекулярном уровне. Твердое тело имеет определенный объем и форму, жидкость имеет определенный объем, но не имеет определенной формы, а газ не имеет определенного объема или формы.
Рисунок \ (\ PageIndex {2} \): представление состояний твердого тела, жидкости и газа. (a) Твердый O 2 имеет фиксированный объем и форму, а молекулы плотно упакованы вместе. (b) Жидкость O 2 соответствует форме контейнера, но имеет фиксированный объем; он содержит относительно плотно упакованные молекулы. (c) Газообразный O 2 полностью заполняет свой контейнер — независимо от размера или формы контейнера — и состоит из широко разделенных молекул.Плазма: четвертое состояние вещества
Технически говоря, существует четвертое состояние материи, называемое плазмой, но оно не встречается в природе на Земле, поэтому мы опускаем его из нашего исследования.
Плазменный шар, работающий в затемненной комнате. (CC BY-SA 3.0; шоколадный дуб).
Твердые
В твердом состоянии отдельные частицы вещества находятся в фиксированных положениях по отношению друг к другу, потому что тепловой энергии недостаточно для преодоления межмолекулярных взаимодействий между частицами. В результате твердые тела имеют определенную форму и объем. Большинство твердых веществ твердые, но некоторые (например, воски) относительно мягкие. Многие твердые тела, состоящие из ионов, также могут быть довольно хрупкими.\ text {o} \ text {C} \), и при правильном давлении мы заметили бы, что все жидкие частицы перейдут в твердое состояние. Ртуть может затвердеть, когда ее температура достигает точки замерзания. Однако при возвращении к условиям комнатной температуры ртуть недолго находится в твердом состоянии и возвращается в свою более распространенную жидкую форму.
Твердые тела обычно имеют составляющие частицы, расположенные в регулярном трехмерном массиве чередующихся положительных и отрицательных ионов, который называется кристаллом .Эффект от этого регулярного расположения частиц иногда виден макроскопически, как показано на рисунке \ (\ PageIndex {3} \). Некоторые твердые тела, особенно состоящие из больших молекул, не могут легко организовать свои частицы в такие правильные кристаллы и существуют как аморфные (буквально «бесформенные») твердые тела. Стекло — один из примеров аморфного твердого тела.
Рисунок \ (\ PageIndex {3} \): (слева) Периодическая структура кристаллической решетки кварца \ (SiO_2 \) в двух измерениях. (справа) Случайная сетевая структура стекловидного \ (SiO_2 \) в двух измерениях.Обратите внимание, что, как и в кристалле, каждый атом кремния связан с 4 атомами кислорода, а четвертый атом кислорода не виден в этой плоскости. Изображения используются с разрешения (общественное достояние)Жидкости
Если частицы вещества обладают достаточной энергией для частичного преодоления межмолекулярных взаимодействий, тогда частицы могут перемещаться друг относительно друга, оставаясь в контакте. Это описывает жидкое состояние. В жидкости частицы все еще находятся в тесном контакте, поэтому жидкости имеют определенный объем.Однако, поскольку частицы могут довольно свободно перемещаться друг относительно друга, жидкость не имеет определенной формы и принимает форму, определяемую ее контейнером.
Жидкости имеют следующие характеристики:
- Нет определенной формы (принимает форму контейнера)
- Имеет определенный объем
- Частицы могут свободно перемещаться друг над другом, но при этом притягиваются друг к другу
Знакомая жидкость — металлическая ртуть. Меркурий — это аномалия. Это единственный известный нам металл, который находится в жидком состоянии при комнатной температуре.\ text {o} \ text {C} \), и при правильном давлении мы заметили бы, что все частицы в жидком состоянии переходят в газовое состояние.
Газы
Если у частиц вещества достаточно энергии, чтобы полностью преодолеть межмолекулярные взаимодействия, тогда частицы могут отделяться друг от друга и беспорядочно перемещаться в пространстве. Это описывает состояние газа, которое мы рассмотрим более подробно в другом месте. Как и жидкости, газы не имеют определенной формы, но, в отличие от твердых тел и жидкостей, газы также не имеют определенного объема.Переход от твердого вещества к жидкости обычно не приводит к значительному изменению объема вещества. Однако переход от жидкости к газу значительно увеличивает объем вещества в 1000 или более раз. Газы имеют следующие характеристики:
- Нет определенной формы (принимает форму контейнера)
- Нет определенного объема
- Частицы движутся случайным образом с незначительным притяжением друг к другу или без него
- Сильно сжимаемый
| Характеристики | Твердые вещества | Жидкости | Газы |
|---|---|---|---|
| форма | определенный | неопределенный | неопределенный |
| объем | определенный | определенный | неопределенный |
| относительная сила межмолекулярного взаимодействия | сильный | умеренный | слабое |
| относительное положение частиц | в контакте и закреплен на месте | в контакте, но не фиксируется | не в контакте, случайные позиции |
Пример \ (\ PageIndex {1} \)
Какое состояние или состояния материи описывает каждое утверждение?
- Это состояние имеет определенный объем, но не имеет определенной формы.
- Это состояние не имеет определенного объема.
- Это состояние позволяет отдельным частицам перемещаться, оставаясь в контакте.
Решение
- Это утверждение описывает жидкое состояние.
- Это заявление описывает состояние газа.
- Это утверждение описывает жидкое состояние.
Упражнение \ (\ PageIndex {1} \)
Какое состояние или состояния материи описывает каждое утверждение?
- В этом состоянии отдельные частицы находятся в фиксированном положении по отношению друг к другу.
- В этом состоянии отдельные частицы находятся далеко друг от друга в космосе.
- Это состояние имеет определенную форму.
- Ответ:
- цельный
- Ответ б:
- газ
- Ответ c:
- цельный
Сводка
- Существуют три состояния материи — твердое, жидкое и газообразное.
- Твердые тела имеют определенную форму и объем.
- Жидкости имеют определенный объем, но имеют форму емкости.
- Газы не имеют определенной формы или объема
Авторы и авторство
Твердые вещества, жидкости и газы — BBC Bitesize
Некоторые переменные: используете ли вы кукурузный крахмал или порошок заварного крема, количество ложек воды и количество ложек кукурузного крахмала или порошка заварного крема.
Попробуйте это упражнение пять раз, но каждый раз меняйте одну переменную.Остальные держите постоянными. Посмотрите, как это влияет на свойства приготовленной вами смеси.
Например, приготовьте два образца загущающей жидкости со следующими параметрами.
Контрольная переменная остается неизменной во время эксперимента. В качестве контрольной переменной в обоих образцах используйте одинаковое количество ложек кукурузного крахмала.
Независимая переменная изменяется во время эксперимента. В каждом образце используйте разное количество ложек воды в качестве независимой переменной.
Зависимая переменная проверяется или измеряется в ходе эксперимента. Измерьте зависимую переменную, наблюдая, как быстро смесь стекает по наклонной поверхности.
состояний материи — научный мир
Цели
Различайте три основных состояния материи.
Описывать различные свойства материи.
Опишите свойства твердого тела, жидкости и газа.
Опишите свойства твердого тела и жидкости.
Опишите свойства газов и жидкостей.
Поймите переходы между состояниями материи.
Поймите, как материя переходит из одного состояния в другое и что влияет на это изменение.
Опишите процессы испарения и конденсации.
Опишите процессы плавления и затвердевания.
Опишите процессы замораживания и плавления.
Объясните сплоченность.
Исследуйте свойства неньютоновской жидкости.
Опишите общий процесс образования кристаллов.
Материалы
Фон
«Состояние материи » — это способ описания поведения атомов и молекул в веществе.
Есть три общих состояния материи:
- Твердые тела — относительно жесткие, определенного объема и формы. В твердом теле атомы и молекулы прикреплены друг к другу. Они вибрируют на месте, но не двигаются.
- Жидкости — определенного объема, но способные изменять форму при течении. В жидкости атомы и молекулы слабо связаны. Они двигаются, но держатся вместе.
- Газы — без определенного объема или формы. Атомы и молекулы свободно перемещаются и расходятся друг от друга.
Плазма иногда упоминается как четвертое состояние материи. Хотя это похоже на газ, электроны свободны в облаке, а не прикреплены к отдельным атомам.Это означает, что плазма по своим свойствам сильно отличается от свойств обычного газа. Плазма возникает естественным образом при пламени, молниях и полярных сияниях.
Другие, более экзотические состояния вещества могут возникать на чрезвычайно высоких уровнях энергии или при чрезвычайно низких температурах, когда атомы и молекулы (или их компоненты) располагаются необычным образом. Ученые также иногда различают кристаллических твердых тел (где атомы и молекулы выстроены в регулярный узор) и стеклообразных твердых тел (где атомы и молекулы прикреплены случайным образом).
Каждое из этих состояний также называется фазой.
Элементы и соединения могут переходить из одной фазы в другую, если энергия добавляется или забирается. Состояние вещества может измениться при изменении температуры. Обычно с повышением температуры вещество переходит в более активное состояние.
Слово «фаза» описывает физическое состояние материи, когда вещество переходит из фазы в фазу, это все та же самая субстанция.
Например, водяной пар (газ) может конденсироваться и превращаться в каплю воды.Если вы положите эту каплю в морозилку, она станет твердой. Независимо от того, в какой фазе он находится, это всегда вода — два атома водорода, присоединенные к одному атому кислорода (H 2 0).
Словарь
когезия : Когда две молекулы одного вида слипаются.
плазма : состояние, подобное газу, в котором электроны не прикреплены к своим атомам, а свободны в облаке; плазма естественным образом возникает в пламени, молниях и полярных сияниях.
Неньютоновская жидкость : жидкость, вязкость которой изменяется в зависимости от приложенного напряжения.
h ypothesis: Предлагаемое объяснение явления для проведения экспериментального исследования.
твердый: Относительно жесткий, определенного объема и формы. В твердом теле атомы и молекулы тесно связаны, поэтому они колеблются на месте, но не перемещаются.
жидкости: Определенный объем, но способный изменять форму при течении.В жидкости атомы и молекулы слабо связаны. Они двигаются, но держатся вместе.
газы: Без определенного объема или формы. Атомы и молекулы свободно перемещаются и расходятся друг от друга.
конденсация: Для перехода из газообразного состояния в жидкое состояние.
испарение: Для перехода из жидкого состояния в газообразное.
отверждение: Переход из жидкого состояния в твердое состояние.
сублимация: Для перехода из твердого состояния непосредственно в газообразное, минуя жидкую фазу.
плавление: Изменение состояния с твердого на жидкое.
осаждение: Изменение состояния непосредственно с газа на твердое.
температура: Степень нагрева вещества, связанная со средней кинетической энергией его молекул или атомов.
pressure: Давление силы на поверхность или объект со стороны другой силы.
точка кипения: Температура, необходимая для превращения жидкости в газ.
точка плавления: Температура, необходимая для превращения твердого вещества в жидкость.
точка замерзания — Температура, необходимая для перехода жидкости в твердое состояние.
НИ ЖИДКОГО ИЛИ ГАЗА, НЕЧЕТНЫХ ВЕЩЕСТВ ИСПОЛЬЗУЕТСЯ
«Наш успех в этой исследовательской работе, — сказал д-р Киран, — обладает потенциалом произвести революцию во всей целлюлозно-бумажной промышленности и открыть новые направления в полимерной науке и науке. химическая обработка.» Растворители для многих областей применения
Многие вещества, в том числе сама вода (которая становится сверхкритической жидкостью при температурах выше 705 градусов по Фаренгейту и давлениях выше 218 атмосфер), могут использоваться в качестве сверхкритических растворителей. Но при очень высоких температурах многие химические молекулы разрушаются, и исследователи должны выбрать сверхкритическую жидкость, которая не разрушит молекулы, которые она предназначена для растворения. Вода в сверхкритическом состоянии достаточно горячая, чтобы поджечь бумагу или дерево.
Более практичным растворителем для многих приложений является сверхкритический жидкий диоксид углерода.
При комнатной температуре и давлении двуокись углерода является обычным газом; это продукт жизнедеятельности, выдыхаемый всеми животными. При атмосферном давлении углекислый газ становится твердым (сухой лед) при охлаждении ниже минус 109 градусов по Фаренгейту. При температуре минус 134 градуса и давлении, в 5,1 раза превышающем атмосферное, углекислый газ находится в так называемой «тройной точке», состоянии, в котором твердая, жидкая и газообразная формы вещества могут сосуществовать в равновесии.
Но при температуре 88 градусов по Фаренгейту и давлении 73 атмосферы диоксид углерода становится сверхкритической жидкостью, способной растворять различные химические вещества, включая белое кристаллическое вещество, известное как кофеин.Производители кофе использовали этот факт в своих интересах; сырые влажные кофейные зерна погружены в сверхкритический жидкий диоксид углерода, который проникает в зерна, растворяя и извлекая кофеин. Когда сверхкритическая жидкость откачивается, кофейные зерна остаются свободными как от кофеина, так и от остатков растворителя, поскольку остаточный углекислый газ, газ при обычных температурах и давлениях, немедленно рассеивается. Процесс удаления кофеина
Удаление кофеина из сверхкритического диоксида углерода является основой процесса, изобретенного в Западной Германии для компании Kaffee-HAG, которая была приобретена в 1979 году корпорацией General Foods Corporation.С начала этого года кофе марки General Foods Sanka в Западной Германии подвергается декофеинизации с использованием сверхкритического жидкого диоксида углерода в качестве экстрагирующего растворителя. Сырые бобы без кофеина отправляются в Соединенные Штаты для обжарки и дальнейшей обработки.
В отличие от воды и других обычных растворителей, сверхкритический диоксид углерода растворяет в кофе только кофеин, оставляя в значительной степени нерастворенными химические вещества, которые придают кофе его характерный вкус и запах; их оставляют потребителю для извлечения из гущи с помощью горячей воды.General Foods утверждает, что основные преимущества этого метода заключаются в том, что он экономичен, сохраняет вкус обычного кофе и не оставляет следов растворителя. Кроме того, исследования на животных показали, что один из химических растворителей, традиционно используемых для удаления кофеина из кофе, хлористый метилен, в высоких дозах является канцерогеном.
По словам доктора Кирана, который участвовал в недавнем симпозиуме в Западной Германии по применению сверхкритических технологий, некоторые пищевые продукты вскоре будут обрабатываться сверхкритическими жидкостями.По его словам, японские производители, например, построили экспериментальную установку для обработки рыбьего жира сверхкритическими жидкостями для удаления запахов и привкусов. Другие предприниматели думают о дезодорировании растительных масел с помощью сверхкритических растворителей.
Простое введение в твердые тела, жидкости, газы
Криса Вудфорда. Последнее изменение: 7 августа 2021 г.
Снег, море, тучи — не часто видишь, что выглядят как — три основных состояния материи (твердое, жидкое и газообразное) в одном и том же месте в одно и то же время.Но мне повезло в один холодный день в начале этого года, гуляя по пляжу сразу после метели. Облака (аэрозоли, медленно образующиеся из невидимого водяного пара) были все еще тяжелыми, и дождь ждал, чтобы упасть, на пляже была пыль от снега (твердая вода), а океан (жидкая вода) входил и выходил, входил и выходил. из. Прямо перед моими глазами была вода в трех ее состояниях одновременно.
Теперь вы можете видеть три состояния различных веществ в любое время.Откройте дверцу холодильника, и вы увидите всевозможные охлаждающие жидкости в банках, твердые комки овощей и сыра, и весь холодильный шкаф, наполненный невидимыми газами — кислородом, азотом, углекислым газом и многими другими, менее значительными. известные, такие как аргон, которые составляют воздух вокруг нас. Но не часто вы видите сразу три состояния одной и той же субстанции. Вы когда-нибудь задумывались, почему? Давайте посмотрим поближе!
Фото: Вода в трех ее состояниях? Снег (твердая вода) на пляже, жидкая вода в океане и водяной пар (вода, охлаждающаяся из газообразной формы в капли воды и кристаллы льда, медленно превращающиеся в видимые облака).В чем разница между водяным паром и паром? Пар — это вода в форме горячего газа, полученного из кипящей воды, тогда как водяной пар — это вода в газовой форме при любой температуре — это может быть холодный водяной пар, полученный из жидкой воды путем понижения давления. Хотя облака могут выглядеть как простые белые газы, на самом деле они являются образцами аэрозолей (жидкостей или твердых тел, рассеянных в газах — так что либо капли воды, либо кристаллы льда размазываются через большую массу воздуха).
Что делает что-то твердым, жидким или газообразным?
В чем разница между твердым телом, жидкостью и газом? Вы можете подумать, что это просто вопрос температуры, но это еще не все.
В твердых телах атомы связаны друг с другом довольно прочно, хотя и немного перемещаются. Не нужно класть твердое тело в емкость; он остается там, где был, потому что его атомы плотно скреплены определенной формой, которая обычно не меняется. Если твердое тело достаточно мягкое, и вы нажмете на него, вы можете заставить его изменить форму, переместив его атомы в новые позиции.
Достаточно нагрейте твердое тело, и вы дадите его атомам достаточно энергии, чтобы они распались, образуя жидкость.В жидкостях атомы расположены более хаотично и немного дальше друг от друга (но не настолько). Силы между ними слабее, и они могут довольно легко покачиваться и течь мимо друг друга. Вот почему текут жидкости. Отведите достаточно тепла от жидкости, и атомы будут замедляться, пока не сформируются твердое тело. Добавьте еще немного тепла, и некоторые из атомов могут вырваться из него, образуя газ.
Газы имеют гораздо более беспорядочно расположенные атомы, чем жидкости или твердые тела.Силы между атомами очень слабые, поэтому атомы могут свободно перемещаться с большим количеством энергии. Жидкость может течь, но газ идет лучше и расширяется, заполняя все доступное ему пространство. Если вы очень сильно сжимаете газ или отводите от него тепло, его молекулы должны сбиться в кучу. Довольно скоро они соединяются, образуя жидкость. Продолжайте сжимать или остывать, и вы плотно соедините их вместе, чтобы получилось твердое вещество.
Иллюстрация: Слева: твердые тела более плотные, чем жидкости: в одном и том же пространстве у них больше атомов.Атомы плотно упакованы вместе и сами по себе сохраняют форму, хотя и перемещаются на месте.
Средний: Жидкости обычно менее плотные, чем твердые тела, но более плотные, чем газы. Их атомы могут двигаться гораздо больше, поэтому им нужен контейнер, чтобы удерживать их на месте (но открытый контейнер обычно подходит на короткие периоды времени). Хотя диаграммы в книгах часто преувеличивают интервалы, важно отметить, что атомы в жидкостях расположены почти так же близко друг к другу, как и в твердых телах.
Справа: газы даже менее плотные, чем жидкости. Их атомы идут туда, куда им заблагорассудится, поэтому им нужен полностью герметичный контейнер (например, резиновый шар), чтобы удерживать их на месте.
Переход из одного состояния в другое
Вы можете превратить любое вещество из твердого в жидкость или газ или обратно, просто изменив его давление и / или температуру, но это не сразу очевидно для нас в мире, где температура и давление практически не меняются. . На Земле температура в широком диапазоне варьируется от -30 ° C до + 30 ° C или (от -70 ° F до + 90 ° F), что кажется огромным отклонением для теплокровного человека, но не беспокоит железный блок. очень.Давление воздуха тоже повышается и понижается. Давление воздуха часто измеряется в единицах, называемых атмосферой, где нормальное давление составляет 1 атмосферу (равную 101 кПа в научных единицах давления, известных как килопаскали). Самое низкое давление воздуха на поверхности Земли (возникающее во время таких вещей, как торнадо) составляет около 0,8 атмосферы (85 кПа), а максимальное — около 1,1 атмосферы (110 кПа). Опять же, разница между этими числами кажется нам огромной и драматической, потому что она сигнализирует об огромных изменениях погоды, но не меняет вещей настолько, чтобы иметь какое-либо значение для деревянного блока или гранитной плиты.
Работа: Изменение состояний: вы можете превратить твердое тело в жидкость, расплавив его, а затем превратить жидкость в газ путем испарения. В обратном направлении вы можете превратить газ в жидкость путем конденсации, а затем превратить жидкость в твердое тело путем замораживания. Но при правильных условиях температуры и давления вы также можете напрямую переводить твердые частицы в газы и из них путем сублимации и осаждения. Процессы, показанные каждой парой стрелок, полностью противоположны друг другу.
В узком диапазоне температуры и давления, в котором мы живем, большинство вещей, с которыми мы сталкиваемся, являются твердыми, жидкими или газообразными, и остаются такими. Вода — очевидное исключение. Когда я сказал, что видел снег, воду и лед вместе в одном и том же месте в одно и то же время на пляже зимой, я обманул — даже совсем немного! Снег на пляже имеет немного более низкую температуру, чем вода в океане, в то время как водяной пар в небе находится под гораздо более низким давлением. Фактически, на моей фотографии три состояния воды сосуществуют, потому что они находятся в совершенно разных условиях на суше, в океане и в небе.По сравнению с водой, другие вещества нуждаются в гораздо более резких изменениях температуры или давления, чтобы изменить свое состояние. Если вы хотите превратить что-то вроде железного блока из твердого в жидкость, вам нужно нагреться до температуры около 1500 ° C (2750 ° F). С другой стороны, чтобы превратить обычный газ, такой как азот, в жидкость, вам нужно охладить его до температуры ниже -200 ° C (-320 ° F).
Кинетическая теория материи
Другой способ понять твердые тела, жидкости и газы — подумать об энергии, которую они содержат.Внутри воздушного шара, наполненного газом, мечутся молекулы, которые многократно врезаются в резиновые стенки и выталкивают их наружу. Воздушные шары остаются вверху, потому что сила молекул газа, толкающих внутреннюю поверхность резины, оказывает давление, равное давлению молекул воздуха, давящих на резину снаружи.
Иллюстрация: Воздушный шар остается надутым, потому что молекулы газа неоднократно сталкиваются с его тонкой резиновой стенкой, выдавливая его наружу. Сила этих столкновений точно уравновешивается эластичностью (растяжимостью) резины.
Поскольку внутри воздушного шара движутся молекулы, у нас также должна быть кинетическая энергия внутри воздушного шара — потому что молекулы имеют как массу, так и скорость. Нагрейте воздушный шар, и вы дадите молекулам больше энергии: они поглощают поставляемое вами тепло и перемещаются немного быстрее (с большей скоростью), поэтому они сильнее врезаются в стены и оказывают большее давление. Вот почему при нагревании воздушного шара он надувается. Точно так же охладите воздушный шар (поместив его в холодильник), и вы лишите молекулы внутри части их энергии.Это означает, что они менее энергично врезаются в стенки шара и оказывают меньшее давление, поэтому шар опускается. Понимание того, как твердые тела, жидкости и газы ведут себя с точки зрения тепла, которым обладают их движущиеся молекулы, известно как кинетическая теория материи .
Что такое абсолютный ноль?
Что, если вы охладите воздушный шар и продолжите охлаждение? Предположим, вы для начала наполняете воздушный шар паром. Охладите немного, и вы получите воздушный шар с небольшим количеством воды внутри, а затем воздушный шар, замороженный льдом.Если вы продолжаете охлаждаться, вы забираете все больше и больше энергии от молекул внутри. Даже атомы или молекулы в твердом теле немного двигаются, но они похожи на людей, бегущих на месте: они более или менее колеблются вокруг фиксированного положения. Чем больше вы охлаждаете твердое тело, тем меньше движутся атомы или молекулы. Сможете ли вы достичь точки, когда атомы или молекулы вообще перестают двигаться? Теоретически да. Если вы вычислите числа, вам нужно охладиться до -273,15 ° C (-459 ° F), что ученые описывают как самую низкую теоретически возможную температуру или абсолютный ноль.На практике кажется невозможным, что мы когда-нибудь сможем так охладить вещи, хотя исследователи подошли довольно близко. Вы можете узнать больше на веб-сайте PBS / NOVA обо всех стремление достичь абсолютного нуля.
Анимация: Когда мы охлаждаемся до абсолютного нуля, атомы или молекулы внутри вещества замедляются. При абсолютном нуле они вообще перестают двигаться.
Если абсолютный ноль действительно является нижним пределом температуры, почему бы нам не перенастроить наши температурные шкалы, начиная с этой нулевой точки? Это то, что британский физик Уильям Томсон (1824–1907, также известный как лорд Кельвин) предложил в 1848 году.Современная шкала Кельвина (также называемая абсолютной шкалой) отсчитывает от 0K в единицах измерения температуры того же размера, что и градусы Цельсия, поэтому точка замерзания воды (0 ° C) становится 273K, а температура кипения воды (100 ° C). ) составляет 373К. Температуры по шкале Кельвина пишутся без знака градуса (°).
Почему твердые тела, жидкости и газы такие разные?
Твердый кусок железа намного тяжелее стакана воды того же размера, а воздушный шар, который во много раз больше, кажется, вообще ничего не весит.Некоторые твердые вещества, такие как резина, очень эластичны: вы можете растянуть резиновую ленту в два или три раза больше ее длины, и она вернется к исходной длине, когда вы отпустите ее. Другие твердые тела (например, стекло или фарфор) разбиваются, если их уронить. Так что же отличает одни твердые тела от других? Что отличает твердые тела от жидкостей и газов?
Фото: Свойства твердого тела: Все эти объекты являются твердыми телами, но имеют очень разные физические свойства. Сталь (банка слева) прочная, хорошо сопротивляется нагреванию, проводит электричество и плавится при высокой температуре.Резина (теннисный мяч, верх) жесткая, эластичная, плавится при низкой температуре и не проводит электричество. Пластик (бутылка, справа) довольно прочный, сжимается, когда вы толкаете его, но обычно не возвращается к своей первоначальной форме, плавится при низкой температуре и не проводит электричество или тепло. Искусственная губка (вверху справа) похожа на резину, но намного более слабая и менее прочная.
Мы описываем все способы поведения того или иного вещества как его свойства . Изменения, через которые он проходит, когда мы толкаем его или тянем, пропускаем через него электричество, нагреваем или пытаемся разбить его молотком, называются его физическими свойствами .То, как он реагирует с другими веществами, называется его химическими свойствами . Мы можем понять физические свойства твердого тела, жидкости или газа, глядя на то, что атомы или молекулы делают внутри него. Например, что делает резину эластичной? Молекулы состоят из длинных цепочек атомов, которые соединены друг с другом более слабыми связями, называемыми поперечными связями. Когда вы растягиваете резину, вы можете развести эти звенья. Когда вы отпускаете, звенья становятся достаточно прочными, чтобы снова стянуть цепи.Вот еще один пример: почему твердые тела такие тяжелые? Потому что так много атомов упаковано в очень маленькое пространство. Это также объясняет, почему большинство твердых тел твердые и нелегко меняют свою форму. Внутри твердого тела атомы плотно упакованы вместе, и их трудно заставить двигаться друг мимо друга. Поскольку атомы не хотят двигаться, твердое тело не может изменить свою форму. Оказывается, мы можем объяснить все свойства твердых тел, жидкостей и газов, глядя на то, что происходит с атомами или молекулами внутри них.Это называется материаловедением.
А как насчет плазмы?
Если вы нагреете жидкость, рано или поздно вы получите газ, но что произойдет, если вы продолжите нагреваться? В конце концов вы создаете четвертое состояние материи, называемое плазмой , в которой молекулы газа не только отделяются друг от друга, но и распадаются на свои субатомные компоненты — электроны и ионы (в данном случае атомы пропускают электроны). Плазма используется, в том числе, в плазменных телевизорах.
Фото: Плазменная «сфера» — это полностью герметичная стеклянная чаша (или, в данном случае, цилиндр), содержащая горячий ионизированный газ, производимый с помощью электричества.Если вы положите руки на стекло, они притянут свободные электроны в плазме, и она начнет кружиться в ответ на ваше прикосновение! Фото Джона Суитса любезно предоставлено ВМС США.
Есть ли другие состояния материи?
Я только что сообщил «плохие» новости о том, что существует четыре состояния материи, а не три. Но это конец истории? Неа! Есть несколько других, которые существуют только в экстремальных условиях. Самый известный из них называются конденсатами Бозе-Эйнштейна (в честь физиков Альберт Эйнштейн и Сатьендра Нат Бос).Они образуются, когда специальные газы, состоящие из бозонов, охлаждаются до температур, близких к абсолютному нулю, и конденсируются в новое состояние вещества. Есть и другие состояния материи, но вы не встретите их в холодильнике, и я не буду вдаваться в них здесь. Также существуют различные «гибридные» состояния, такие как жидкие кристаллы, которые частично являются жидкими, а частично — твердыми кристаллическими. Когда мы говорим, что существует три или четыре состояния материи, вы можете видеть, что это действительно упрощение!
Иллюстрация: Как образуется конденсат Бозе-Эйнштейна.Атомы конденсируются из красной, желтой и зеленой областей в более плотные синие и белые области. Фото NIST (Национальный институт стандартов и технологий) любезно предоставлено Wikimedia Commons.
(другие) состояния материи: гораздо больше, чем просто твердое тело, жидкость и газ
На протяжении многих веков считалось, что существует только три состояния материи: твердое, жидкое и газообразное (три, которые присутствуют и стабильны в нашем мире). И вода — это вещество, которое лучше всего их представляет, потому что это единственное вещество, которое естественным образом существует в трех состояниях.
Но развитие новых технологий, способных создавать все более и более экстремальные и энергичные условия в лабораториях , означает, что за последние годы были обнаружены пять других состояний (плюс последний кандидат, который только что появился в 2018 году).
Плазма
Состояние плазмы — это состояние, в котором присутствуют газы, содержащиеся внутри неоновых ламп, люминесцентных ламп и, конечно же, плазменных телевизоров. Это также состояние, которое характеризует северное сияние и молнии.Фактически, по оценкам, 99% вещества в наблюдаемой Вселенной — это плазма.
Плазменный шар в затемненной комнате. Кредит: Шоколадный дубПлазма — это ионизированный газ при высокой температуре. Образуется катионами (молекулы или атомы с положительным зарядом) и свободными электронами (с отрицательным зарядом), между которыми присутствуют значительные электростатические силы. Хотя в целом полный электрический заряд равен нулю, внутри частицы имеют заряд.Это означает, что, в отличие от газов, плазма являются проводниками электричества и могут удерживаться внутри магнитных полей.
Кварк-глюонная плазма (КГП)
Это состояние материи, в котором (предполагается) вся материя Вселенной находилась всего на одну миллионную долю секунды после Большого взрыва и непосредственно перед тем, как начать охлаждаться и переходить в другие менее энергичные состояния. В этот момент — характеризуемый экстремальной температурой и энергией — вся материя будет обнаружена в виде плотного супа элементарных частиц : кварков и глюонов, движущихся со скоростью, близкой к скорости света.Таким образом, силы притяжения между ними настолько слабы, что каждый может сохранять свою индивидуальность и свободно перемещаться.
Через несколько секунд после Большого взрыва строительные блоки материи вышли из горячего энергетического состояния, кварк-глюонной плазмы (QGP). Кредит: Университет ХьюстонаПервое свидетельство существования состояния QGP, также известного как кварковый суп, было обнаружено в 2003 году и подтверждено в 2005 году на ускорителях CERN. Там было обнаружено, что кварк-глюонная плазма ведет себя не как идеальный газ (как предполагалось), а как сверхтекучая жидкость с минимальной вязкостью .До сих пор QGP был получен только в очень специфических установках и в течение очень ограниченного времени, и его приложения все еще изучаются.
Спины квантовой жидкости
Физик и лауреат Нобелевской премии Филип Уоррен Андерсон был первым, кто предсказал существование спинов квантовой жидкости в 1970-х годах, но только в 2016 году их фактическое существование было доказано. Любопытно то, что при определенных условиях давления и температуры некоторые минералы обнаруживают области в этом состоянии, в том числе герберсмитит.
При определенных условиях давления и температуры герберсмитит обнаруживает области в состоянии спинов квантовой жидкости. Кредит: Роб ЛавинскийСпин — это свойство электронов и других субатомных частиц. Проще говоря, это как если бы каждый электрон содержал крошечный внутренний компас. В большинстве материалов (и в состояниях материи) спины электронов выровнены друг относительно друга. Однако в состоянии спина квантовой жидкости спины электронов никогда не выравниваются, а остаются в постоянной флуктуации даже при температурах, близких к абсолютному нулю, в то время как в остальных состояниях вещества спин при этой температуре замерзает.
Спиновое состояние квантовой жидкости придает материалу уникальные магнитные характеристики , применение которых в настоящее время изучается.
Вырожденное состояние
При экстремальных давлениях, таких как те, которые возникают в ядрах некоторых звезд, частицы сжимаются до минимального размера. Поскольку две частицы не могут занимать одно и то же пространство в один и тот же момент, это заставляет атомы вырождаться и терять свою структуру: электроны покидают свои орбиты и начинают двигаться со скоростью все ближе и ближе к скорости света , создавая расширяющую силу, которая компенсирует внешнее давление.
При экстремальных давлениях, таких как те, которые возникают в ядрах некоторых звезд, частицы сжимаются до минимального пространства. Предоставлено: NASA / JPL-Caltech / 2MASSЕсли он продолжает расти и превышает так называемый предел Чандрасекара, тогда внешнее давление становится неприемлемым, и атомные ядра также дегенерируют, теряя свою структуру, коллапсируя в скопление нейтроны и протоны.
Конденсат Бозе-Эйнштейна
В 1924 году Сатьендра Бозе и Альберт Эйнштейн предсказали существование нового состояния материи, применив статистику к квантовой механике.По словам двух физиков, когда материя охлаждается до температуры чуть выше абсолютного нуля, в некоторых случаях составляющие ее частицы попадают в один и тот же низкий энергетический уровень или квантовое состояние. Эта ситуация нарушает принципы квантовой физики: частицы становятся неотличимыми друг от друга и образуют своего рода «суператом».
На этом рисунке показаны атомы в конденсате Бозе-Эйнштейна (БЭК), выталкиваемые лазерным светом. Кредит: Национальный институт стандартов и технологийНо только в 1995 году Корнеллу, Виману и Кеттерле удалось получить конденсат Бозе-Эйнштейна благодаря использованию новых и более мощных лазеров и электромагнитов.С тех пор было доказано, что это состояние характеризуется сверхтекучестью и сверхпроводимостью, а также тем, почему оно способно замедлять скорость света, который проходит через него со скоростью всего несколько метров в секунду.
Суперионный лед
Вода как начало и конец. Вода — единственное вещество, присутствующее в природе в трех классических состояниях, и это также вещество, в котором в начале 2018 года была обнаружена новая форма или состояние устройства: суперионный лед.Для этого кристаллы льда подвергались воздействию давления, в 2 миллиона раз превышающего атмосферное, и температуры, близкой к 5000 ° C. Это жестокое давление вынуждает лед принять очень компактную упаковку , но в то же время высокая температура растворяет связи молекулы воды. В результате в суперионном льду сосуществуют две фазы: жидкая и твердая. Атомы кислорода принимают кристаллическую структуру, через которую протекают ядра водорода.
Считается, что суперионный лед может существовать в больших количествах на газообразных и ледяных планетах-гигантах, таких как Уран.Предоставлено: NASA / JPL-CaltechСчитается, что суперионный лед может существовать в больших количествах на газообразных и ледяных планетах-гигантах, таких как Уран или Нептун, внутри которых находятся подходящие условия для его образования.






 — М.: ВАКО, 2012.-336с. — (В
помощь школьному учителю).
— М.: ВАКО, 2012.-336с. — (В
помощь школьному учителю).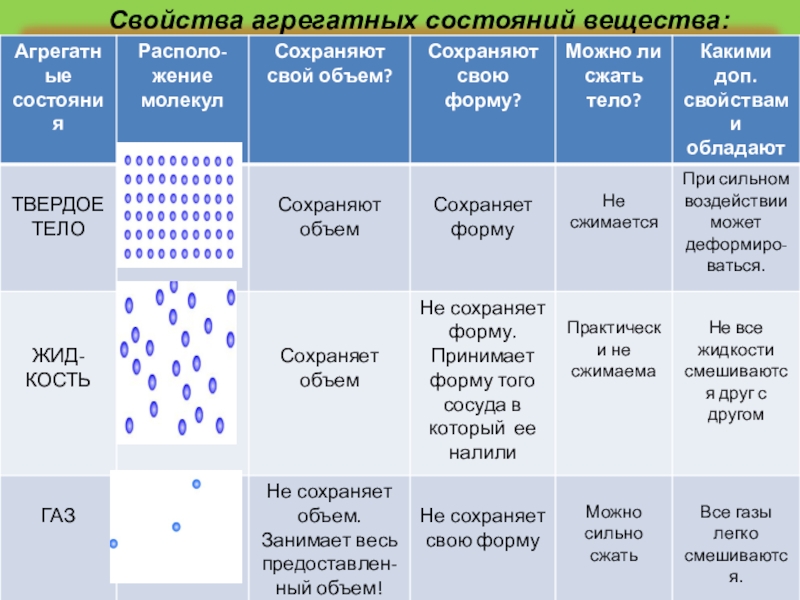 Газы легко заполняют собой любой объем
Газы легко заполняют собой любой объем

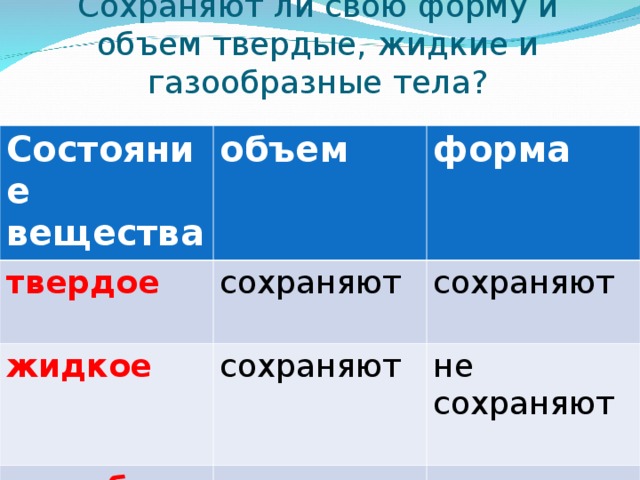 Когда твердое вещество превращается в газ, оно называется сублимацией.
Когда твердое вещество превращается в газ, оно называется сублимацией.